Пути утилизации кислорода клеткой
Большая часть кислорода, потребляемого клеткой (около 80 %), используется, как указано, в митохондриях с участием цитохромоксидазы. Это так называемый оксидазныйпуть. При этом происходит полное восстановление кислорода, причем субстрат не реагирует с кислородом непосредственно. Данный путь дает клетке энергию в виде АТФ. Помимо цитохромоксидазы существуют другие оксидазы (ФМН и ФАД-зависимые), которые катализируют реакции окисления веществ с образованием перекиси водорода
Наряду с этим существует другой путь окисления – оксигеназный. Он не дает клетке энергии, кислород включается в субстрат с образованием новой гидроксильной или карбоксильной группы. Этот путь происходит в основном в мембранах эндоплазматического ретикулума (микросомах). Путем микросомного окисления осуществляется α- и ω-окисление жирных кислот, синтез ненасыщенных жирных кислот, стероидов. Таким путем обезвреживаются ксенобиотики, т. е. чужеродные для организма вещества (лекарства, ядохимикаты, косметические препараты). Ферменты, осуществляющие такое окисление, называются оксигеназами. Различают диоксигеназы, которые включают в молекулу субстрата два атома молекулы кислорода. Более распространены в клетках монооксигеназы(гидроксилазы). Они катализируют реакции, при которых в молекулу субстрата включается один атом из молекулы кислорода, второй же атом кислорода восстанавливается при этом до воды. Монооксигеназные системы представляют собой короткие цепи переноса электронов и протонов, источником которых служит чаще всего восстановленный НАДФ+, реже НАД+ или аскорбиновая кислота. Активатором кислорода при этом является цитохром Р450 – одноцепочечный хромопротеин с молекулярной массой 50 кДа.
Примерная схема монооксигеназной цепи выглядит следующим образом:
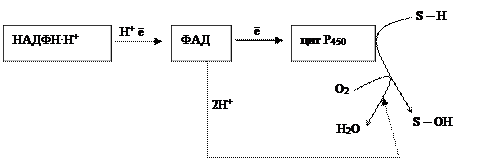 |
Смысл такого процесса заключается в том, что ксенобиотики, которые обычно гидрофобны, гидроксилируясь, становятся более гидрофильными, что способствует их обезвреживанию и выведению из организма с желчью или мочой. С участием микросомных систем осуществляется также биосинтез стероидов, желчных кислот, витамина Д3.
С появлением в атмосфере кислорода, а он появился тогда, когда возникли фотосинтезирующие организмы, стало возможным более эффективно использовать энергию, т. е. возник механизм окислительного фосфорилирования. Но, с другой стороны, вместе с этим кислород принес и новую опасность. При неполном восстановлении молекулы кислорода образуются высокоактивные формы (свободные радикалы), которые могут повреждать белки, нуклеиновые кислоты, липиды и способны даже убить живую клетку. Активные формы кислорода или свободные радикалы образуются в качестве промежуточных продуктов в ходе микросомного окисления, при работе дыхательной цепи, при воздействии ионизирующего излучения, при самопроизвольном окислении ряда веществ (гемоглобин). Свободные радикалы — молекулы, содержащие неспаренные электроны, агрессивные молекулы, которые атакуют другие молекулы с целью отнять у них электрон. К ним относятся: супероксидный радикал (О2–), перекисный радикал (О22–), гидроперекисный радикал (НО2–), пероксид водорода (Н2О2), гидроксильный радикал (НО–).
Свободные радикалы стимулируют разрывы в молекулах нуклеиновых кислот, нарушают функции белков, ведут к деполимеризации протеогликанов соединительной ткани, повреждают ненасыщенные жирные кислоты клеточных мембран, запуская, тем самым, механизм перекисного окисления липидов (ПОЛ). Вместе с тем свободные радикалы кислорода играют и положительную роль, так как участвуют в осуществлении фагоцитами и
Т-лимфоцитами их защитной функции.
Повышенное образование в организме свободных радикалов кислорода ведет к «окислительному стрессу», который может привести к повреждению мембран и гибели клетки. Поэтому в организме существуетантиоксидантная защита от свободных радикалов.
Различают неферментативную и ферментативную защиту клеток. Важнейшим компонентом неферментативной защиты является витамин Е (токоферол), витамин размножения.
Являясь жирорастворимым витамином, он всасывается вместе с липидами, поступает в лимфатическую систему и кровяное русло, а оттуда — в ткани. Токоферол защищает ненасыщенные жирные кислоты клеточных мембран от перекисного окисления, предохраняет от окисления SH-группы мембранных белков, защищает от окисления двойные связи в молекулах каротинов и витамина А. Токоферол (совместно с витамином С) способствует включению селена в состав активного центра глутатионпероксидазы — важнейшего фермента антиоксидантной защиты клеток. Он контролирует синтез гема, цитохромов, стабилизирует биологические мембраны.
Ферментативная защита клеток от свободных радикалов (антиоксидантная защита) осуществляется с помощью следующих ферментов:
· супероксиддисмутазы (превращает супероксидные радикалы в менее токсичную перекись водорода);
· каталазы (разлагает перекись водорода на воду и кислород);
· глутатионпероксидазы — главная система защиты эритроцитов от разрушительного действия перекиси водорода. В качестве кофермента глутатионпероксидаза использует трипептид – глутатион.
Дата добавления: 2015-03-11; просмотров: 2380;
