Способы разделения и очистки белков.
1. Всем больным с подозрением на кардиогенный шок проводят катетеризацию легочной артерии, используя вены шеи, предплечья, бедра.
Давление заклинивания в легочной артерии (которое может быть приравнено к диастолическому давлению в легочной артерии при отсутствии выраженного обструктивного заболевания легких) должно быть в пределах 15-18 мм рт. ст. или выше.
Если давление заклинивания в легочной артерии ниже, то организм или обезвожен (например, вследствие массивного применения диуретиков), или же у него развился синдром брадикардии-гипотензии (рефлекс Бецольда—Яриша), часто отмечаемый при нижнем инфаркте миокарда.
В таких случаях внутривенно вводят либо изотонический раствор натрия хлорида, альбумин, плазму, либо низкомолекулярный декстран до тех пор, пока давление заклинивания в легочной артерии не достигнет уровня 18 мм рт. ст.
Действие изотонического раствора натрия хлорида и глюкозы непродолжительно, так как эти вещества легко проходят через капиллярные мембраны, покидая таким образом циркуляторное русло.
При выраженной брадикардии можно применять внутривенно атропина сульфат или электрокардиостимуляцию.
2. У всех больных с подозрением на кардиогенный шок давление мониторируют прямым (инвазивным) способом, причем катетер по возможности подводят максимально близко к аорте.
Определение давления в периферической артерии (например, в лучевой) может давать неправильные результаты.
Предпочтительнее применять относительно длинные катетеры, вводимые через лучевую, плечевую или бедренную артерии.
Через катетеры в периферической и легочной артериях постоянно медленно вводят раствор гепарина (1 ЕД/мл в 5% растворе глюкозы или изотоническом растворе натрия хлорида). Для измерения диуреза в мочевой пузырь вводят катетер Фолея.
3. Пока больному устанавливают катетер в периферическую и легочную артерию для оценки тяжести шока и измерения давления заклинивания в легочной артерии.
АД следует поддерживать дофамином, добутамином, норадреналином, амриноном или различными комбинациями этих препаратов (например, дофамин + добутамин).
Если в дальнейшем у больного обнаружится гиповолемия (по данным катетеризации легочной артерии), то инфузию вазопрессорных аминов постепенно прекращают и начинают проводить замещение ОЦК.
4. Лечение больных, у которых диагноз кардиогенного шока подтвержден данными инвазивного измерения АД и соответствующей клинической картиной, состоит в следующем:
а) начинают инфузию дофамина (3-5 мкг/кг в 1 мин) или добутамина (3-10 мкг/кг в 1 мин). Если эффект недостаточен, дозу увеличивают до 20-50 мкг/кг в 1 мин (для дофамина) или до 20-40 мкг/кг в 1 мин (для добутамина).
Если и эта доза недостаточна, пробуют вводить оба препарата одновременно или к одному из препаратов присоединяют инфузию норадреналина со скоростью 2-8 мкг/ кг в 1 мин.
Изопротеренол при кардиогенном шоке противопоказан.
Для больного с умеренной артериальной гипотензией (систолическое АД 80-90 мм рт. ст.) бывает достаточно введения добутамина.
При более выраженном снижении АД назначают дофамин или норадреналин;
б) больного быстро доставляют в лабораторию ангиографии и предпринимают попытку устранить окклюзию коронарной артерии с помощью баллонной ангиопластики;
в) мобилизуют группу контрпульсации (внутриаортальной или наружной); больного консультирует кардиолог (если это не сделано ранее), а руководителя блока интенсивной терапии ставят в известность о наличии больного, находящегося в состоянии кардиогенного шока.
5. При кардиогенном шоке часто оказывается эффективной внутриаортальная или наружная контрпульсация.
Некоторым больным показано неотложное коронарное шунтирование.
Самые тяжелые больные с признаками кардиогенного шока или те из них, состояние которых не улучшилось в течение 24—48 ч от начала контрпульсации и проведения коронарной баллонной ангиопластики, должны быть направлены на оперативное лечение.
Состояние больных, находящихся в состоянии кардиогенного шока, вызванного механическими осложнениями острого инфаркта миокарда (митральная регургитация или разрыв межжелудочковой перегородки), нередко улучшается после хирургического вмешательства.
Больным с диффузной гипокинезией и акинезией левого желудочка, но без механических осложнений инфаркта миокарда операция коронарного шунтирования, как правило, не показана, но баллонная ангиопластика у них часто бывает эффективной.
Коронарную баллонную ангиопластику проводят в ангиографической лаборатории на фоне контрпульсации.
Затем больного возвращают в блок интенсивной терапии или же перевозят в операционную.
Если решено производить катетеризацию, то исследования должны быть выполнены как можно раньше.
Классификация липидов, их химические св-ва и биологические ф-ии. Липиды- это гетерогенная многочисленная группа органических соединений со сходными физико-химическими свойствами и структурой. По химич. строению они делятся на: простые липиды (Эфиры жир. Кислот и спиртов); конъюгированные (сложные) и производные липидов (вит. D, Е и К). Простые липиды делятся на: 1. Жиры, 2. Масла(эфиры жир. кислот и глицерола); 3. Воска (эфиры жир. кислот с длинноцепочечными алифатическими спиртами). Конъюгированные липиды делятся на:1. Фосфолипиды ( фосфатидные кислоты, лецитины, плазмалогены); 2. Гликолипиды (цероброзиды, ганглиозиды и цитолипиды); 3. Сульфалипиды; 4. Липопротеины. По функциям бывают:1. Структурные и рецепторные компоненты мембран и клеточных поверхностей; 2. Энергетическое ДЕПО; 3. Сигнальные молекулы и биологические регуляторы. Классы липопротеинов учавствующих в переносе липидов и холестерина в организме человека: 1. Хилонекроны; 2. Липопротеины очень низкой плотности; 3. Липопротеины низкой плотности; 4. Липопротеины высокой плотности. Ф-ии липидов: 1. Структурная.В сочетании фосфолипиды с белками образуют биологические мембраны; 2.Энергетическая. В процессе окисления жиров происходит высвобождение большого количества энергии, именно она и идёт на образование АТФ; 3. Теплоизоляционная и защитная; 4. Смазывающая и водоотталкивающая; 5. Регуляторная.
5 (3).Общая характеристика биологических функций белков.Белки- высокомолекулярные органические в-ва,состоящие из соед-ых в цепочку пептидной связью L- аминокислот. В организме человека белки выполняют следующие функции: Каталитическая или ферментативная- все ферменты имеют белковую природу. Регуляторная- специал. Белки-маски осущ-ют регуляцию доставки к генам в ДНК. Рецепторная- ф-я заключ-ся в избир-ом связывании гормонов,биологически активных в-в и медиаторов на поверхности мембран или внутри клеток. Транспортная- только белки осущ-ют перенос в-в в крови, например, липопротеины, гемоглобин, трансферрин. Структурная- белки формируют в-во соед-ой ткани (коллаген, эластин, кератин, протеогликаны), участвуют в построении мембран и цитоскелета. Сократительная- сущ-ет ряд белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин). Генно-регуляторная- осуществление белками регуляции процессов в клетке или в организме, что связано с их способностью к приему и передаче информации. Трофическая- белки яв-ся источником С.S.N и др. элементов. Иммунологическая или защитная- все антитела имеют белковую природу: интерфероны, фибриногены. Сигнальная- белки участв. В передаче сигнала в клетку. Энергетическая- при расщеплении аминокислот сост-их белки, клетка получает 16-18% необходимой энергии.
6 (2).Роль белков в жизнедеятельности организма. Современные представления о структуре белков.Белки́- высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью аминокислот. Роль: белки служат материалом для построения клеток, тканей и органов, образования ферментов и большинства гормонов, гемоглобина и друг. соединений. Формируют соединения, обеспечивающие иммунитет к инфекциям. Участвуют в процессе усвоения жиров, углевод, витаминов, минерал. в-в, белки- важная часть питания человека. Структура: крайне важна трёхмерная структура- формируется в результате взаимодействия структур более низких уровней. Выделяют 4 уровня структуры белка: Первичная- последовательность аминокислот в полипептидной цепи. Именно в таком виде белок образ-ся на рибосомах. Благодаря водородным связям м/д радикалами отдельные участки белковой молекулы закручив-ся в спираль или формируют складчатый слой. Вторичная- образ-ся в результате взаимодействия мж функционирующими группами, входящими в состав пептидного остова. Различают два варианта вторич структуры: a-спираль и b- конфигурацию. Третичная- пространственное строение полипептидной цепи, представлена структура в виде нитки запутанной, если ее положить на ладонь и покатать другой ладонью- альфа спираль свернута в компактную глобулу. В стабилизации третичной структуры принимают участие: ковалентные связи (дисульфидные мостики); ионные (в аминокислот. остатках); водородные связи; гидрофобные взаимодействия (на поверхности молекул). Четверичная- когда белки состоят из 2-ух и более полипептид. Цепей, связ-ых м/д собой нековалентными (не пептидными и не дисульфидными) связями.
7. Пептидная связь и ее характерные черты. Первичная структура белков и ее свойства. Вторичная структура белков: виды, факторы стабилизации.Первичная структура белка - последовательность аминокислотных остатков в полипептидной цепи. Пептидная связь образуется за счет карбоксильной группы одной аминокислоты и аминогруппы другой аминокислоты. Пептидная связь является частично двойной и частично одинарной. Заместители по отношению к пептидной связи могут находиться в цис- или транс-положении, причем транс-пептидная связь является более стабильной. Свойства первичной структуры белка: 1.Детерминированность – последовательность аминокислот в белке генетически закодирована. Информация о последовательности аминокислот содержится в ДНК; 2. Уникальность – для каждого белка в организме характерна определенная последовательность аминокислот. Пептидные цепи белков организованы во вторичную структуру, стабилизированные водородными связями. Атом кислорода каждой пептидной группы образует при этом водородную связь c NH-группой, соответствующей пептидной связи. При этом формируются следующие структуры: α-спираль, β-структура и β-изгиб. α-Спираль-наиболее выгодная структура. На один ее виток приходится 3,6 аминокислотного остатка. β-структура -образована за счет межцепочечных водородных связей между соседними участками полипептидной цепи, т.к. внутрицепочечные контакты отсутствуют. Полипептидная цепь в β-структуре сильно вытянута и имеет спиральную или зигзагообразную форму. Водородные связи менее прочны по сравнению с таковыми при антипараллельном расположении аминокислотных остатков. β-изгиб.Глобулярные белки имеют шарообразную форму.
8 (5).Третичная структура белка. Глобулярные и фибриллярные белки. Связи стабилизирующие третичную структуру. Примеры организации третичной структуры белков.Третичная структура- пространственное строение полипептидной цепи, структура представлена в виде запутан. Нитки, если ее положить на ладонь и покатать ее другой ладонью- в виде глобулы. В стабилизации третич. структуры принимают участие: ковалентные связи (мж двумя остатками цистеинами- дисульфидные мостики); ионные (в аминокислот остатках); водородные связи; гидрофобные (на поверхности молекул). Белки по форме клубка делят на 2 группы: глобулярные (близки к форме шара) и фибриллярные (нитевидные,близкие к форме эллипса). Пример- альбулин, кератин. Фибрилляр. белки имеют палочковобразную вытянутую форму, нерастворимы в воде и физически прочные (коллаген, эластин, миозин, фибрин- свертывает кровь). Глобулярные- водорастворимы, выполняют динамическую ф-ю- ферменты иммуноглобулины и транспортные белки гемоглобин и альбулин. Коллагены- молекулы состоят из 3 полипептидных цепей, называемых α-цепями. В состав коллагенов могут входить 3 одинаковые или разные цепи. Первичная структура α-цепей коллагена необычна, т.к каждая третья аминокислота в полипептидной цепи представлена глицином, так же имеется пролин и аланин. В коллагене отсутствуют такие аминокислоты, как цистеин и триптофан, α гистидин, метионин и тирозин находятся лишь в очень небольшом количестве. В составе первичной структуры α-цепи коллагена содержится также необычная аминокислота - гидроксилизин. Изменение в первичной структуре коллагена может приводить к развитию наследственных болезней. Эластин- в отличие от коллагена, образующего прочные фибриллы, способные выдержать большие нагрузки, эластин обладает резиноподобными свойствами. Нити эластина, содержащиеся в тканях лёгких, в стенках сосудов, в эластичных связках, могут быть растянуты в несколько раз по сравнению с их обычной длиной, но после снятия нагрузки они возвращаются в исходную форму. Эластин содержит довольно много пролина и лизина, но лишь немного гидроксипролина; полностью отсутствует гидроксилизин.
9 (6). Принципы организации четвертичной структуры белков. Кооперативные изменения конформации субъединиц. Примеры реализации кооперативных эффектов (гемоглобин, аллостерические ферменты). Четвертичная структура- когда белки состоят из двух и более полипептидных цепей, связанных между собой нековалентными (не пептидными и не дисульфидными)связями, обычно связаны гидрофильно-гидрофобными связями, при помощи водородных и ионных. Подобные белки называются олигомерами, а составляющие их индивидуальные полипептидные цепи-протомерами, мономерами или субъединицами.В результате формируется молекула в виде шара (глобуляр.белки) или нити(фибриллярные).Отдельные глобулы называются субъединицами. У гемоглобина, например, имеется по две α и β субъединицы. Наличие нескольких субъединиц -увеличивает степень насыщения кислородом.Четвертичная структура свойственна большинству ферментов.Кооперативные изменения конформации субъединиц.Субъединица – это функционально активная часть молекулы белка.Конформа́ция- пространственное расположение атомов в молекуле определенной конфигурации, обусловленное поворотом вокруг одной или нескольких одинарных сигма-связей.Кооперативные изменения конформации субъединиц- это изменение расположения атомов в определенной молекуле всех полипептидных цепей (протомеров) четвертичной структуры белка(олигомеров) при присоединении лиганда (молекулы или ионы, связанные с центральным атомом) только к одному из белков.Конформационные изменения ,произошедшие в других протомерах(цепях),облегчают присоединение следующей молекулы ,что вызывает новые конформационные изменения в белке и ускорение связывания следующей молекулы.Т.о каждая присоединяющаяся молекула будет присоединятся легче первой в 300 раз,а также способствует более легкому отщеплению последующих молекул.Аллостерические ферменты - это ферменты, активность которых регулируется количеством молекул субстрата и эффекторами. Они играют важную роль в метаболизме.Аллостерическая регуляция имеет большое значение в следующих ситуациях: при анаболических процессах и при катаболических процессах.Аллостерические ферменты обладают свойством кооперативности: взаимодействие аллостерического эффектора с аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или увеличивает каталитическую активность фермента.
10 (7).Денатурация и ренатурация белка. Денатурирующие факторы.Денатурация белков- это потеря белками их естественных свойств (растворимости, гидрофильности и др.) вследствие нарушения пространственной структуры их молекул.Процесс денатурации отдельной белковой молекулы, приводящий к распаду её «жёсткой» трёхмерной структуры, иногда называют плавлением молекулы. Как правило, денатурация белка необратима, но в некоторых случаях после устранения денатурирующего агента может произойти «ренатурация» — восстановление вторичной и третичной структур, свойств, т.е белки возвращают свою природную структуру. Механизмы денатурации. Любое заметное изменение внешних условий, например, нагревание или обработка белка щелочью приводит к последовательному нарушению четвертичной, третичной и вторичной структур белка. Обычно денатурация вызывается повышением температуры, действием сильных кислот и щелочей, солей тяжелых металлов, некоторых растворителей (спирт), радиации и др. Денатурация часто приводит к тому, что в коллоидном растворе белковых молекул происходит процесс агрегации частиц белка в более крупные. Наглядным примером яв-ся- образование «белка» при жарке яиц.
11 (10). Классификация, структурные компоненты и биологические функции сложных белков (хромопротеины, гемопротеины, флавопротеины, металлопротеины). Хромопротеины состоят из простого белка и связанного с ним окрашенного небелкового компонента. Различают гемопротеины (содержат в качестве простетической группы железо), магнийпорфирины и флавопротеины (содержат производные изоаллоксазина). Функции: уч-ют в фотосинтезе, дыхание клеток и целостного организма; транспорт O2 и CO2; ОВР; свето-и цветовосприятие и др. Магнийпорфирин вместе с белком обеспечивает фотосинтетическую активность растений, катализируя расщепление H2O на H2 и O2 . Гемопротеины катализируют обратную реакцию – образование H2O, связанное с освобождением энергии. Флавопротеины содержат прочно связанные с белком простетические группы, представленные изоаллоксазиновыми. Некоторые флавопротеины содержат ионы металлов. Типичными представителями флавопротеинов, являются ксантин-оксидаза, альдегидоксидаза, ацил-КоА-дегидрогеназа и транспортирующий электроны флавопротеин.. Негемовое железо связывается с белковым компонентом, отличающимся от гемсодержащих хромопротеинов. Железо ковалентно связано с атомом серы остатка цистеина в белке. При кислотном гидролизе такого белка освобождается железо и H2S. К группеГемопротеиновотносятся гемоглобин и его производные, миоглобин, хлорофиллсодержащие белки и ферменты (вся цитохромная система, каталаза и пероксидаза). Все они содержат в качестве небелкового компонента структурно сходные железо (или магний)-порфирины, но различные по составу и структуре белки. К Металлопротеинамотносятся биополимеры, содержащие белок и ионы какого-либо одного или нескольких металлов: ферритин, трансферрин, гемосидерин. Белки, координационно связанные с атомами металлов в составе сложных белков-ферментов, для которых металл служит или мостиком между белковым компонентом и субстратом, или, что более вероятно, металл в них непосредственно выполняет каталитическую функцию.
Способы разделения и очистки белков.
Получение белков из биологического материала (тканей, органов) требует такие последовательные стадии как: дробление биологического материала и разрушение клеточных мембран; фракционирование органелл, содержащих те или иные белки; перевод белков в растворённое состояние; разделение смеси белков на индивидуальные белки. Для разрушения биологического материала используют методы: создание однород. структуры в ткане, метод попеременного замораживания и оттаивания, а также обработку клеток ультразвуком. Создание однород. структуры в ткане-определ. ткань помещают в сосуд с пестиком, пестик вращается и измельчает и растирает ткань о стенки сосуда.Замораживания и оттаивания ткани- в результатеобразующиеся кристаллы льда разрушают оболочки клеток.После разрушения ткани нерастворимые части осаждают центрифугированием. Удаление из раствора небелковых веществ. Нуклеиновые кислоты, липиды и др. небелковые вещества можно удалить из раствора, используя их свойства. Липиды легко удаляются из р-ра добавлением орган-ких растворителей, например ацетона. Методы очистки белков. Очистка белков от других белков, находящихся в р-ре, полученном из данной ткани. Т.к. белки обладают лабильностью, при работе с белками следует избегать денатурирующих воздействий, поэтому выделение и очистка белков происходят при низких температурах. Также нужно учитывать термостабильность и устойчивость в кислых р-ах. Сначала нужно удалить из р-ра основную массу балластных белков, которые значительно отличаются от выделяемого белка свойствами.
13 (26). Денатурация и ренатурация. Молекулярная гибридизация нуклеиновых кислот. Денатурация свойственна макромалекулам, имеющим пространственную организацию. Она может быть вызвана нагреванием, воздействием химических веществ, которые нарушают Ван-дер-Вальсовы взаимодействия, разрывают водородные связи, стабилизирующие вторичную и третичную структуры. При нагревании происходит разделение двунитевой ДНК на одиночные полинуклеотидные цепи. При медленном охлаждении они снова воссоединяются по принципу комплементарности, образуются двунитевая полинуклеотидная цепь ДНК – этот процесс называется ренатурацией и при быстром охлаждении она не происходит. Денатурация бывает полной и частичной, обратимой и необратимой. Необратимой будет при разрушении фосфодиэфирных связей между нуклеотидами. Гибридизация нуклеиновых кислот. Все клетки одного организма содержат абсолютно одинаковые молекулы ДНК. Поэтому, если из клеток разных тканей выделить ДНК, денатурировать её и разделить цепи, а потом смешать одноцепочечные молекулы, то одноцепочечные молекулы, выделенные из разных клеток могут полностью комплиментарно спариться- образовать совершенный гибрид ДНК-ДНК.В том случае, если смешиваются ДНК разных организмов, то степень их комплим. спарив. будет зависеть от степени родстатва организмов или видов-образуются несовершенные гибриды ДНК-ДНК.
14 (12).Понятие о ферментах. структурно-функциональная организация ферментов.Ферменты-белки обладающие каталит. активностью, способны ускорять биохим-е р-ции. По своему строению могут быть простыми и сложными белками. Простетическую (небелковую) группу ферментов называют коферментом, а белковую — апоферментом. Апоферментная и коферментная группы сами по себе неактивны, лишь соединенные друг с другом более или менее прочными связями они образуют функционально активный комплекс, получивший название холофермента. Апоферментом определяется специфичность фермента (способность его взаимодействовать только с определенным веществом (субстратом) или группой веществ); тогда как коферментная группа часто выступает в роли акцептора тех или иных отщепляемых от субстрата атомов или функциональных групп, а в некоторых случаях выполняет и каталитическую функцию. Структурно-функц. организация ферментов.Центры ферментов: молекула фермента взаимодействует с S не всей своей поверхностью, а определенными участками. На поверхности фермента различают: Активный центр (это участок фермента, который взаимодействует с S. Наиболее часто в состав актив. центров входят функциональные группы таких аминокислот: ОН – группы серина, треонина, тирозина; SН – группы цистеина; NН – группа гистидина; СООН – группы глутамата и аспартата;NН2 – группы аргинина и лизина.В сложных ферментах в активный центр входят кофакторы (небелковые компоненты): простетические группы, коферменты, ионы металлов. Активный центр является комплементарным к строению S, имеется соответствие Е и S как “ключа и замка”. В структуре активного центра выделяют: участок, который связывается с S: контактный (“якорный”) участок;каталитический участок, в состав которого входят химические группы, принимающие непосредственное участие в преобразовании S. Кроме активного центра, некоторые ферменты имеют дополнительный, регуляторный, аллостерический центр, с которым взаимодействуют аллостерические регуляторы (эффекторы, модуляторы). Аллостерические эффекторы могут быть позитивными (активаторами), которые повышают каталитическую активность фермента или негативными (ингибиторами), которые ее снижают. Активный и аллостерический центры локализуются на разных субъединицах фермента. При взаимодействии аллостерического центра с эффекторами происходят конформационные изменения активного центра фермента, что приводит к увеличению или снижению его активности. Ферменты, имеющие аллостерический центр, называются регуляторными.
15 (16). Классификация и номенклатура ферментов.Все ферменты делятся на 6 классов по типу катализируемой реакции. Каждый класс делится на несколько подклассов. Классы:1.Оксидоредуктазы; 2.Трансферазы; 3.Гидралазы; 4.Лиазы; 5.Изомеразы; 6.Лигазы (синтетазы).1.Оксидредуктазы – ферменты, катализирующие ОВР: а) аэробные дегидрогеназы (оксидазы). Отщепляют водород от субстрата и переносят его на молекулу кислорода, б) анаэробные дегидрогеназы – катализируют перенос водорода от субстрата на любой другой акцептор, кроме кислорода, в) цитохромы – это ферменты, переносящие электроны. г) пероксидазы – гемсодержащие оксидоредуктазы. Они отщепляют водород от субстрата и переносят его на Н2О22. Трансферазы – ферменты, переносящие группы атомов от одного субстрата к другому. При этом один субстрат донор, а другой – акцептор.- аминотрансферазы, переносят NH2;- метилтрансферазы, переносят CH3;- фосфотрансферазы, переносят PO3H2;- ацилтрнсферазы.3. Гидролазы – ферменты, катализирующие разрыв одинарных связей с участием воды, присоединяемой по месту разрыва связи(они принимают участие в реакциях гидролиза). Все ферменты пищеварительного тракта относятся к гидролазам: эстеразы – разрывают сложно-эфирную связь; пептидазы – разрывают пептидную связь; гликозидазы – разрывают гликозидные связи. 4. Лиазы - ферменты осуществляют разрыв углеродных связей без участия воды. Выделяют: декарбоксилазы – катализируют отщепление CO2. альдолазы – катализируют расщепление связи между атомами углерода. гидратазы – разрыв двойной связи с присоединением воды по месту разрыва двойной связи. Ферменты, отщепляющие воду – реакция дегидратации. При этом образуется двойная связь. 5.Изомеразы – ферменты, катализирующие реакции изомеризации и обеспечивающие внутримолекулярную перестройку. 6.Лигазы (синтетазы) – катализируют образование более сложных вещ-в из более простых. При этом требуется энергия из вне. Обязательно участие АТФ или других. Номенклатура ферментов: 1)Тривиальная номенклатура – названия случайные, без системы и основания, например трипсин, пепсин, химотрипсин.2) Рабочая номенклатура – название фермента составляется из названия субстрата или продукта реакции, типа катализируемой реакции и окончание –аза, например лактатдегирогеназа. 3) Систематическая, научная - L-лактат-НАД-оксидредуктаза.4) Все ферменты имеют цифровой шифр, например ЛДГ - 1.1.1.27.Первая цифра говорит о типе катализируемой реакции, указывая на номер класса. Вторая уточняет действие фермента – номер подкласса. Третья указывает природу разрываемой связи в молекуле субстрата - подподкласс. Четвёртая – порядковый номер фермента.
16 (13). Общие принципы ферментативного катализа. Отличие ферментов от неорганических катализаторов.В основу современной теории о ферм.катализе положена теория Михаэлеса и Ментена. Ведущую роль в механизме ферментативного катализа играет образование фермент-субстратного комплекса. По этой теории весь процесс катализа можно разделить на 3 этапа:1)образование фермент-субстратного комплекса. Происходит диффузия субстрата к ферменту и субстрат, в соответствии с принципом комплиментарности, связывается с активным центром фермента. Реагенты связаны водородными, ионными, гидрофобными, в некоторых случаях и ковалентными связями. Эта стадия непродолжительна, зависит от концентрации субстрата и от скорости диффузии его к активному центру. Энергия активации исходных веществ при этом изменяется незначительно. На этой стадии проявляется эффект концентрирования субстрата на поверхности фермента – эффект ориентации. 2)происходит последовательное преобразование первичного фермент-субстратного комплекса в 1 или несколько активированных. Эта стадия медленная, ее длительность зависит от величины энергии активации данной реакции. В эту стадию происходит разрыв старых связей и образование новых, при этом энергия активации значительно снижается. 3)отделение продуктов от активного центра фермента и диффузия их в окружающую среду. Эта стадия непродолжительна, ее скорость определяется скоростью диффузии продуктов в окружающую среду. Отличия между ферментами и неорг. катализаторами (общие свойства ферментов): сложность строения; высокая мощность действия; специфичность; это вещ-ва с регулируемой активностью; действуют в мягких условиях организма.
17. Кинетика ферментативных реакций. Зависимость скорости ферментативных реакций от концентрации субстрата, фермента, факторов среды (рН,температуры).Число молекул S, претерпивающих изменение в течение минуты, в расчете на единицу веса E при оптимальных условиях его действия называется молекулярной активностью E. При увеличении кол-cтва E скорость ферментативной р-ции повыш-ся до некоторого предела, который характеризуется количеством S, доступным действию E. Зависимость скорости ферментативной реакции от концентрации S может быть описана уравнением:
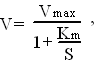
где V -скорость ферментативной реакции, Vmax - максимальная скорость ее при бесконечно большой концентрации субстрата, S - концентрация субстрата в моль/л, Кm - константа Михаэлиса ( она соответствует концентрации субстрата, при которой скорость реакции равна половине максимальной). Зависимость скорости от кол-ва фермента. При условии избытка S скорость р-ции пропорциональна кол-ву E, но при избыточном количестве E прирост скорости реакции будет снижаться, поскольку уже не будет хватать S. Зависимость скорости реакции от температуры. Скорость ферментативных реакций зависит от температуры: при повышении температуры на каждые 10 °С скорость увеличивается примерно вдвое (правило Вант-Гоф-фа). Однако для ферментативных реакций это правило справедливо лишь в области низких температур — до 50-60 °С. Зависимость скорости реакции от рН. Изменение рН приводит к изменению степени ионизации ионогенных групп в активном центре, а это влияет на сродство S к активному центру и на каталитический механизм. Кроме того, изменение ионизации белка вызывает конформационные изменения молекулы E. Зависимость скорости реакции от времени. По мере увеличения времени инкубации скорость реакции снижается .Это может происходить вследствие уменьшения концентрации S, увеличения скорости обратной реакции (в результате накопления продукта прямой реакции), ингибирования E продуктом реакции, денатурации фермента. При количественном определении E и кинетических исследованиях измеряют начальную скорость реакции.
18. Уравнение Михаэлиса- Ментен. Зависимость скорости ферментативной реакции от концентрации субстрата. В 1913 г. Михаэлис и Ментен создали теорию ферментативной кинетики, исходя из того, что фермент (Е) вступает во взаимодействие с субстратом (S) с образованием промежуточного фермент субстратного комплекса (ЕS), который далее распадается на фермент и продукт реакции по уравнению:

19 (15). Механизм действия ферментов. Специфичность действия ферментов(стереохимическая, реакционная и субстратная: абсолютная, групповая). Структура и роль каталитического центра. 1. Происходит активация фермента путем связывания с аллостерическим центром регуляторных веществ это приводит к изменению конформации активного центра фермента и увеличению его способности связывать молекулу субстрата. 2. происходит 'узнавание' ферментом своего S. 3. происходит формирование неактивного фермент-субстратного комплекса за счет образования гидрофобных и водородных связей между радикалами аминокислотных остатков субстратного центра и соответствующими группировками в молекуле S. 4. образуется активный фермент-субстратный комплекс. При этом происходит хим. преобразование S с участием каталитического центра и кофермента. В результате этого молекула S меняет свою пространственную конфигурацию, в ней происходит перераспределение энергии и уменьшается прочность связей. 5.фермент-субстратный комплекс становиться нестабильным и затем преобразуется в комплекс фермент-продукт, который распадается на продукты реакции и фермент. Фермент из реакции выходит в неизменном виде.-Специфичность по отношению к субстрату – это предпочтительность фермента к субстрату определенной структуры в сравнении с другими субстратами. Различают 4 вида субстратной специфичности ферментов:1. Абсолютная специфичность – способность фермента катализировать превращение только одного S. .2. Относительная специфичность – фермент катализирует превращение нескольких S, имеющих один тип связи. 3. Относительная групповая специфичность – фермент катализирует превращение нескольких S, имеющих один тип связи, но требуется наличие определенных функциональных групп, входящих в состав S. 4. Стереохимическая специфичность – фермент катализирует превращение только одного стереоизомера. Реакционная специфичность фермента -это специфичность фермента к определённой реакции. Каталитический центр - это та область актив. центра фермента, которая непосредственно участвует в хим. преобразованиях S. Формируется он за счет радикалов двух, иногда трех аминокислот, расположенных в разных местах полипептидной цепи фермента, но пространственно сближенных между собой за счет изгибов этой цепи. Если фермент явл-ся сложным белком, то в формировании каталитического центра нередко участвует простетическая группа молекулы фермента (кофермент). Коферментную функцию выполняют все водорастворимые витамины и жирорастворимый витамин K. Образование каталитического центра происходит одновременно с формированием третичной структуры белковой молекулы фермента. Чаще всего в его входят остатки серина, цистеина, тирозина, гистидина, аргинина, аспарагиновой и глутаминовой кислот.
20 (14). Кофакторы и коферменты, их значение для деятельности ферментов. Коферментные функции витаминов.Коферменты — это орган. вещ-ва аминокислотной природы, непосредственно участвующие в катализе в составе фермента. Простые, относятся обычно к классу гидролаз, практически все гидролитические ферменты состоят только изаминокислот. Кроме того, некоторые лиазы, а вот все остальные классы ферментов в основном явл. сложными белками(для каталитической активности многих ферментов кроме белковой части необходим второй компонент-кофактор). Есть каталитически актив. фермент вместе с кофактором-холофермент. Это каталитически актив. фермент, состоящий из белковой и небелковой части кофактора. Белковая часть холофермента-апофермент. У холофермента ни белковая часть апофермента, ни кофактор в отдельности не обладают заметной каталитической активностью. Оказывается апофермент резко повышает каталитическую активность кофактора, а кофактор в свою очередь стабилизирует белковую часть, делает ее более устойчивой и менее уязвимой к денатурирующим агентам. Кофакторы- это некоторые полипептиды, группы нуклеотидов и их производные и, наконец, ионы некоторых металлов. Классификация: 1) Кофакторы жирного ряда (глютатион, липоевая кислота, долихол фосфат). 2 Кофакторы алифатического ряда (убихинон или коэнзим Q). 3) Кофакторы гетероциклического ряда. 4) не содержащие витаминов - геминовые кофакторы. Основой этих кофакторов является гемовое железо. 5) Кофакторы-нуклеотиды.Коферментные функции витаминов. Ф-ции водорастворимых вытаминов-образование коферментов и простетич. групп ферментовитамины. Связанные с разл. витаминами ферменты принимают участие во мн. важнейших процессах обмена веществ: энергетич. обмене, биосинтезе и превращениях аминокислот, жирных кислот, пуриновых и пиримидиновых оснований. Некоторые жирорастворимые витамины также выполняют коферментные функции. Ф-ции др. жирорастворимых витаминов: витамин Е стабилизирует и защищает ненасыщ. липиды биол. мембран от окисления; витамин D необходим для осуществления транспорта ионов Са и остатков фосфорной кислоты через клеточные барьеры в процессах их всасывания в кишечнике, реабсорбции в почках и мобилизации из скелета.
21 (19). Регуляция активности ферментов. Ковалентная модификация. Аллостерическая регуляция. Каталитические и регуляторные центры. Понятие об иммобилизированных ферментов и их применение в медицине. Ферменты-регулируемые катализаторы.В качестве регуляторов могут выступать метаболиты, яды. Различают: активаторы – вещ-ва, увеличивающие скорость реакции;ингибиторы – вещ-ва, уменьшающие скорость реакции. Активация ферментов. Различные активаторы могут связываться либо с активным центром фермента, либо вне его. К группе активаторов, влияющих на активный центр, относятся: ионы металла, коферменты, сами S. Активация с помощью металлов протекает по различным механизмам: а)металл входит в состав каталитического участка активного центра; б)металл с S образуют комплекс; в)за счет металла образуется мостик между S и активным центром фермента.S также являются активаторами. При увеличении концентрации S скорость р-ции повышается. По достижению концентрации насыщения S эта скорость не изменяется. Если активатор связывается вне активного центра фермента, то происходит ковалентная модификация фермента: 1) частичный протеолиз. 2) фосфорилирование - дефосфорилирование. Аллостерическая регуляция. Аллостерич-е ферменты построены из двух или большего числа субъединиц. Одна субъединица имеет каталитический центр, др.— регуляторный центр. Если в среде есть аллостерический ингибитор, он присоединяется к регуляторному центру, что ведет к изменению конформации регуляторной субъединицы; вследствие этого изменяется конформация и каталитической субъединицы, в том числе каталитического активного центра. В результате активность фермента снижается. Чем выше концентрация аллостерического ингибитора, тем больше молекул фермента блокируется им и тем меньше скорость превращения субстрата. Аналогично происходит и активация ферментов при действии аллостерических активаторов. Иммобилизованные ферменты – это ферменты, ковалентно присоединенные к любому органическому или неорганическому полимеру. Их можно многократно использовать, при этом их активность снижается незначительно. При этом обеспечивается их высокая специфичность действия и высокая стабильность. В медицине иммобилизованные ферменты используются как лекарственные препараты.
22(18).Ингибирование активности ферментов: обратимое и необратимое; конкурентное, неконкурентное и бесконкурентное.Ингибитор – это вещ-во, вызывающее специфическое снижение активн-ти фермента. Инактивация –денатурация белка в результате действия денатурирующих агентов. По прочности связывания ингибитора с ферментом ингибиторы делят на обратимые и необратимые. Необратимые ингибиторы прочно связаны и разрушают функциональные группы молекулы фермента, которые необходимы для проявления его каталитической активн-ти. Обратимые игнибиторы, например прозерин для холинэстеразы. Обратимое ингибирование зависит от концентрации субстрата и ингибитора и снимается избытком субстрата. По механизму действия выделяют: 1) Конкурентное (изостерическое) ингибирование – это торможение ферментативной р-ции, вызванное связыванием ингибитора с активным центром фермента. При этом ингибитор имеет сходство с S. В процессе происходит конкуренция за активный центр: образуются фермент-субстратные и ингибитор-ферментные комплексы.2) Неконкурентное ингибирование – торможение, связанное с влиянием ингибитора на каталитическое превращение, но не на связывание фермента с S. В этом случае ингибитор может связываться и с активным центром (каталитический участок) и вне его. Присоединение ингибитора вне активного центра приводит к изменению конформации (третичной структуры) белка, вследствие чего изменяется конформация активного центра. Это затрагивает каталитический участок и мешает взаимодействию субстрата с активным центром. Неконкурентные ингибиторы: а)цианиды. Они связываются с атомом железа в цитохромоксидазе и в результате этого фермент теряет свою активность, а т.к. это фермент дыхательной цепи, то нарушается дыхание клеток и они гибнут. б)ионы тяжёлых металлов и их органические соединения. в)фармакологические средства, которые должны поражать ферменты злокачественных клеток. Сюда же относятся ингибиторы, использующиеся в сельском хозяйстве, бытовые отравляющие вещества.3) Субстратное ингибирование (бесконкурентное) – торможение ферментативной реакции, вызванное избытком S. Происходит в результате образования фермент-субстратного комплекса, неспособного подвергаться каталитическому превращению. Лекарственные препараты как конкурентные ингибиторы.Например.:четвертичные аммониевые основания ингибируют ацетилхолинэстеразу, катадизирующую реакцию гидролиза ацетилхолина на холин и уксусную кислоту. При добавлении ингибиторов активность ацетилхолинэстеразы уменьшается, концентрация ацетилхолина(S) увеличивается, что сопровождается усилением проведения нервного импульса. Ингибиторы холинэстеразы используют при лечении мышечных дистрофий.
23. Применение ферментов в медицине. Понятие об энзимопатологии, энзимодиагностике и энзимотерапии.1.Химический метод – количественное определение S или продуктов с помощью хим. реагентов. 2. Спектрофотометрический метод – измерение скорости ферментативной реакции по изменению поглощения S при характеристической длине волны.3. Манометрический метод – определение кол-ва газа, выделяющегося в процессе р-ции (оксидазы – по поглощению О2, декарбоксилазы – по выделению СО2). 4. Поляриметрический метод – фиксируется изменение оптического вращения. 5. Хроматографический – количественное определение S или продуктов с помощью различных видов хроматографии: бумажной (анализ сахаров), тонкослойной (гликозидов со сложными агликонами). Удельная активность – это число единиц активности (Е) на мг белка. Энзимопатология-заболевания, которые обусловлены отсутствием или снижением активности ферментов. В основном это – наследственные болезни, обусловленные генетическими нарушениями(дефекты ферментов обмена фенилаланина возникают при снижении активности фенилаланингидроксилазы-фенилпировиноградная олигофрения). Энзимодиагностика это использование определения активности ферментов в биологиче ских жидкостях для выявления тех или иных заболеваний. Энзимотерапия это использование ферментных препаратов для лечения заболеваний.
24 (22). Структурные компоненты нуклеиновых кислот. Биологическое значение и функции нуклеиновых кислот.Нуклеиновая к-та — высокомолекулярное органическое соединение, полинуклеотид, образованный остатками нуклеотидов. Нуклеиновые кислоты ДНК и РНК присутствуют в клетках всех живых организмов и выполняют функции по хранению, передаче и реализации наследственной информации. В состав нуклеиновых кислот входят азотистые основания двух типов: пуриновые - аденин (А), гуанин (G) и пиримидиновые - цитозин (С), тимин (Т) и урацил (U).Одна из основных функций нуклеиновых кислот состоит в детерминации синтеза белков. Информация о структуре белков, закодированная в нуклеотидной последовательности ДНК.
25. Вторичная и третичная структура ДНК. Типы РНК и их ф-ции. Вторичная структура ДНК-двойная спираль. Эта структура образуется из двух взаимно комплементарных антипараллельных полидезоксирибонуклеотидных цепей, закрученных относительно друг друга и общей оси в правую спираль. При этом азотистые основания обращены внутрь двойной спирали, а сахарофосфатный остов — наружу. В формировании вторичной структуры ДНК участвуют: а)водородные связи между комплементарными основаниями; б)электростатические взаимодействия; в)Ван-дер-Ваальсовы взаимодействия(связи между положительными и отриц. ионами). Третичная структура(клубок) — пространственное строение всей молекулы белка или другой макромолекулы, состоящей из единственной цепи. В формирование этой цепи участвуют: а)ковалентные связи (между двумя остатками цистеина — дисульфидные мостики); б)ионные связи между противоположно заряженными боковыми группами аминокислотных остатков; в)водородные связи; г)гидрофильно-гидрофобные взаимодействия. На поверхности молекулы оказываются полярные гидрофильные боковые группы. Типы РНК и их функции.Три типа РНК: – транспортные (тРНК), матричные (мРНК) и рибосомальные (рРНК). Они различаются по первичной структуре, молекулярной массе, конформации, продолжительности жизни и выполняемым функциям. Транспортные РНК-описывается универсальной моделью «клеверного листа». В состав тРНК входят минорные основания, представленные метилированными основаниями, изомерами и аналогами пиримидинов. Минорные основания делают тРНК устойчивыми к действию нуклеаз и поддерживают определенную третичную структуру молекулы. Антикодон имеет жесткую архитектуру, которая позволяет ему быстро считывать мРНК. Матричные РНК эукариот и прокариот различаются по строению. Этот тип РНК имеет одинаковое строение 5′- и 3′-концов.На 5′ конце присутствует модифицированный нуклеотид 7-метилгуанозин-5′-трифосфат – кэп. Рибосомальные РНК принимают участие в образовании рибонуклеопротеинов, формирующих немембранные комплексы – рибосомы. Клетки прокариот и эукариот содержат рибосомы, имеюшие общий план строения. В рибосомы входят высокомолекулярные рРНК, дающие начало 30S-40S- и 50S-60S-субчастицам рибосом; рРНК взаимодействуют с мРНК и аминоацил-тРНК в процессе трансляции. рРНК содержат несколько модифицированных нуклеотидов. Чаще всего это метильные производные азотистых оснований или рибозы. Вторичная структура рРНК характеризуется спирализацией самой на себя полирибонуклеотидной цепи. Биспиральные и линейные участки этих молекул формируют постоянные вариабельные домены, которые затем укладываются в более компактные структуры более высокого порядка.
26 (23). Строение и уровни организации нуклеиновых кислот. Первичная структура нуклеиновых кислот. Видовые различия первичной структуры нуклеиновых кислот. Нуклеиновая к-та — высокомолекулярное органическое соединение, полинуклеотид, образованный остатками нуклеотидов. В состав нуклеиновых кислот входят азотистые основания двух типов: пуриновые - аденин (А), гуанин (G) и пиримидиновые - цитозин (С), тимин (Т) и урацил (U). Уровни структурной организации: 1. первичная структура. РНК и ДНК построены однотипно – представлены полинуклеотидной цепью, состоящей из отдельных мононуклеотодов, соединённых между собой 3’→5’-фосфодиэфирными связями. 2. вторичная структура. Представляет собой двойную спираль, состоящую из 2 полинуклеотидных цепей, закрученных вокруг одной общей оси. Эти цепи антипараллельны, т.е. одна идет в направлении 5’→3’, а другая 3’→5’. Пуриновому основанию одной цепи соответствует пиримидиновое основание другой цепи – эти основания комплиментарны друг другу. Вторичная структура стабилизируется водородными связями и гидрофобными взаимодействиями. Видовые различия первичной структуры: Существуют два типа нуклеиновых кислот – дезоксирибонуклеиновые кислоты (ДНК) и рибонуклеиновые кислоты(РНК). те, и другие представляют собой полимерные молекулы, построенные из мономерных блоков – нуклеотидов: ДНК – из дезоксирибонуклеотидов, а РНК – из рибонуклеотидов.
27 (24). Вторичная и третичная структура ДНК. Строение и организация хроматина. Вторичная структура ДНК-двойная спираль. Эта структура образуется из двух взаимно комплементарных антипараллельных полидезоксирибонуклеотидных цепей, закрученных относительно друг друга и общей оси в правую спираль. При этом азотистые основания обращены внутрь двойной спирали, а сахарофосфатный остов — наружу. В формировании вторичной структуры ДНК участвуют: а)водородные связи между комплементарными основаниями; б)электростатические взаимодействия; в)Ван-дер-Ваальсовы взаимодействия(связи между положительными и отриц. ионами). Третичная структура(клубок) — пространственное строение всей молекулы белка или другой макромолекулы, состоящей из единственной цепи. В формирование этой цепи участвуют: а)ковалентные связи (между двумя остатками цистеина — дисульфидные мостики); б)ионные связи между противоположно заряженными боковыми группами аминокислотных остатков; в)водородные связи; г)гидрофильно-гидрофобные взаимодействия. На поверхности молекулы оказываются полярные гидрофильные боковые группы. Хроматин-это вещ-во хромосом — комплекс ДНК, РНК и белков. Хроматин находится внутри ядра клеток эукариот и входит в состав нуклеоида у прокариот. Именно в составе хроматина происходит реализация генетической информации, а также репликация и репарация ДНК. Основную массу хроматина составляют белки гистоны. Гистоны являются компонентом нуклеосом, — надмолекулярных структур, участвующих в упаковке хромосом. Нуклеосомы располагаются довольно регулярно, так что образующаяся структура напоминает бусы. Нуклеосома состоит из белков четырех типов: H2A, H2B, H3 и H4. В одну нуклеосому входят по два белка каждого типа. Нить ДНК с нуклеосомами образует нерегулярную структуру (фибриллу). Если хроматин упакован плотно-гетерохроматин, ДНК, находящаяся в гетерохроматине не транскрибируется. В интерфазе гетерохроматин обычно располагается по периферии ядра (пристеночный гетерохроматин). Полная конденсация хромосом происходит перед делением клетки. Если хроматин упакован неплотно-эухроматином. Плотность упаковки хроматина во многом определяется модификациями гистонов — ацетилированием и фосфорилированием.
28. Репликация ДНК как один из видов матричных синтезов. Этапы репликации. Особенности процесса в эукариотических клетках.Репликация (самоудвоение, биосинтез) ДНК. Основные этапы: 1. образование репликативных вилок при участии ДНК-раскручивающих белков, вызывающих разрыв водородных связей между комплементарными основаниями. 2. синтез новых нитей ДНК при участии ДНК-полимеразы, катализирующей образование фосфодиэфирной связи между новыми нуклеотидами. Присоединение нуклеотидов идет в соответствии с принципом комплементарности. Синтез идет 5’-конца к 3’-концу. На одной цепи синтез происходит непрерывно, а на другой - прерывается с образованием коротких фрагментов. В результате на одной цепи образуются короткие фрагменты - фрагменты Оказаки; 3. соединение коротких фрагментов с помощью ДНК-лигазы с образованием дочерних нитей. В результате репликации на одной материнской нити синтезируются 2 комплементарных дочерних ДНК (из одной молекулы ДНК образуются 2 копии ДНК).Значение репликации состоит в передаче информации от ДНК матери к дочерней ДНК. Особености репликация линейных геномов эукариот:геномы кольцевые замкнутые характерны для многих бактерий, их плазмид и некоторых вирусов. У большинства др. организмов геном представлен линейными молекулами ДНК в составе одной или нескольких хромосом. Существует так называемая проблема отстающей цепи ДНК. Синтез отстающей цепи ДНК происходит в виде коротких фрагментов Оказаки , для инициации синтеза которых требуются РНК- затравки. После удаления затравки на конце одной из вновь синтезированных молекул ДНК образуется одноцепочечная, которая не может быть заполнена ДНК-полимеразой, поскольку она не функционирует в отсутствие праймера. Вследствие этого в каждом раунде репликации должно было бы происходить укорачивание хромосом с обоих концов, что приводило бы к потере генетической информации, закодированной в концевых фрагментах ДНК. Кроме того, большие размеры молекул ДНК, заключенных в индивидуальные хромосомы, требуют специальной организации их реплицирующего аппарата.
29. Репликация плазмид. Особенности репликации вирусного генома. Интерфероны, их биологическое действие и применение в медицине.Плазмида- внехромосомный самовоспроизводящийся генетич. элемент бактерий. Представляет собой кольцевую двухцепочечную молекулу ДНК, закрученную в суперспираль. Каждая плазмида является самостоятельным репликоном, сама контролирует собственную репликацию и поддерживается в клетке в определенном, характерном для нее числе копий. Особенности репликации вир-го генома: I ) вирусная частица (вирион) содержит только один вид нуклеиновых кислот — или ДНК, или РНК; 2) вирионы не имеют собственного метаболизма, не содержат клеточных органелл, в том числе рибосом, и очень часто состоят только из нуклеиновой кислоты, заключенной в белковую оболочку=>вирусы способны размножаться исключительно за счет использования метаболического аппарата другой клетки.Цикл размножения вируса начинается с его прикрепления к поверхности клетки. Вирион содержит рецепторы, узнающие определенные вещества мембраны клетки-хозяина; После прикрепления вирион проникает чз мембрану внутрь клетки; иногда в клетку попадает только нуклеиновая кислота вириона. Затем с использованием аппарата клетки-хозяина начинается репликация вирусного генома и синтез вирусных белков; из них путем самосборки образуются новые вирионы, которые освобождаются из клетки, либо разрушая ее. Интерфероны — ряд белков со сходными св-ми, выделяемых клетками организма в ответ на вторжение вируса. Они способны подавлять внутриклеточное размножение ДНК- и РНК-вирусов. В медицине интерфероны применяют для профилактики и лечения респираторных вирусных инфекций.
30 (29). Биосинтез РНК (транскрипция). Строение РНК-полимеразы. Зависимость локализации считываемого участка и направления считывания от структуры промотора. Этапы транскрипции. Посттранскрипционная модификация РНК. Процессинг РНК. Транскрипция- передача информации с ДНК на РНК. Элементарная единица транскрипции-оперон (транскриптон)- участок ДНК, подвергающийся транскрипции. В опероне выделяют информативные участки - экзоны и неинформативные участки - интроны. В начале оперона выделяют промотор (P) - это начальный участок оперона, к которому присоединяется РНК-полимераза. Рядом с промотором располагается оператор (О) - регуляторная зона, место присоединения генов-регуляторов. В конце оперона располагается терминатор (Т) - участок, содержащий стоп-сигнал.Строение РНК-полимеразы. Биосинтез РНК осуществляется ДНК-зависимыми РНК-полимеразами. В ядрах эукариотов обнаружены 3 специализированные РНК-полимеразы: РНК-полимераза I,синтезирующая пре-рРНК; РНК-полимераза II,ответственная за синтез пре-мРНК; РНК-полимераза III,синтезирующая пре-тРНК. Этапы транскрипции: 1. инициация; 2. элонгация; 3. терминация;4.процессинг (созревание) РНК. Инициация - присоединение ДНК-зависимой РНК-полимеразы к промотору, что приводит к разрыву водородных связей между комплементарными нуклеотидами и расхождение нитей ДНК. Элонгация - это передвижение РНК-полимеразы вдоль нити ДНК, сопровождающееся образованием фосфодиэфирных связей между рибонуклеотидами. Присоединение рибонуклеотидов происходит в соответствии с принципом комплементарности. Этот синтез идет от 5' конца к 3'. Данная фаза протекает до тех пор, пока ДНК-полимераза не достигнет стоп-сигнала->терминация. В результате процессов транскрипции образуется транскрипт (пре-иРНК). Он почти полностью соответствует транскриптону. Посттранскрипционная модификация РНК. Процессинг РНК. Начинается следующий этап - процессинг - посттранскриптационное созревание РНК. Это удаление излишков - вырезаются неинформативные участки; сплайсинг - сшивка, соединение информативных участков. При этом иРНК укорачивается.Из пре-иРНК образуется иРНК. Далее иРНК соединяется с белком-информером, в результате чего образуется комплекс иРНК+ белок =информосома, который может выходить из ядра и транспортироваться в цитоплазму к рибосоме, где начинается – трансляция.
31. Основной постулат молекулярной биологии. Генетический код и его характерные черты. Акцепторная роль тРНК. Синтез аминоацил-тРНК как регуляторный механизм трансляции. Основной постулат молекулярной биологии.Передача наследственной информации от материнской клетки к дочерней осуществляется при помощи ДНК-репликация. Для использования генетической информации необходимы РНК, образуемые на матрице ДНК-транскрипция. Далее РНК непосредственно участвуют на всех этапах синтеза белковых молекул трансляция, обеспечивающих структуру и деятельность клетки. Генетический код. Генетическая информация, содержащаяся в ДНК и в иРНК, заключена в последовательности расположения нуклеотидов в молекулах. Последовательность расположения нуклеотидов в иРНК определяет последовательность расположения аминокислот в белках. Этот код называют генетическим. Код триплетен. В состав РНК входят 4 нуклеотида: А, Г, Ц, У(каждая из 20 аминокислот зашифрована последовательностью 3 нуклеотидов, т. е. триплетом, который получил название кодон)Код однозначен. Каждый триплет шифрует только одну аминокислоту. Код универсален. Код един для всех живущих на Земле существ. Акцепторная роль тРНК. тРНК-осуществляет доставку аминокислот к рибосоме. Связывается с аминокислотами, образуя комплекс аминоацил-тРНК, при помощи аминоацил-тРНК-синтетазы. Синтез аминоацил-участие в регуляции.Аминоацил-тРНК-синтетаза— фермент, катализирующий образование аминоацил-тРНК в реакции этерификации определенной аминокислоты с соответствующей ей молекулой тРНК. Для каждой аминокислоты существует своя аминоацил-тРНК-синтетаза.
32 (31). Этапы трансляции. Состав трансляционного аппарата клетки. Строение и механизм функционирования рибосом. Роль РНК в процессе трансляции. Участие белковых комплексов инициации, элонгации и терминации в биосинтезе полипептидной цепи. Трансляция- перевод генетического текста иРНК в последовательность аминокислот в белке.Этапы трансляции:1. Рекогниция. Происходит связывание АК со своей тРНК. 2. Инициация. Состоит из 7 фаз: а) подготовка рибосомы к трансляции. Рибосома взаимодействует с фактором инициации , в результате разделяется на малую и большую субъединицы. б) подготовка РНК-матрицы к трансляции; в) подготовка инициаторной аминоацил-тРНК. г) образование инициирующего комплекса. д) связывание мРНК с инициирующим комплексом. е) поиск и комплементарное взаимодействие со стартовым кодоном. ж) формирование 80S-рибосомы. В образовавшейся рибосоме выделяют 2 участка: Р-участок, там будет происходить образование пептидных связей; А-участок (аминоацильный участок) – служит для присоединения аминоацильной- тРНК. 3. Элонгация состоит из 3-х фаз: а)присоединение следующей аминоацил-тРНК в соответствии со смыслом следующего кодона матрицы; б) пептизация; в)транслокация или перемещение. Рибосома перемещается на 1 кодон в направлении 3’-конца тРНК. При достижении рибосомой нонсенс-кодона элонгация прекращается и наступает терминация. 4. Терминация. Нонсенс-кодон распознается белковыми R-факторами (факторы освобождения) в А-участке рибосом. В результате действия R-факторов обеспечивается диссоциация элементов трансляционного аппарата и в цитоплазму высвобождаются рибосома, иРНК, полипептид. Трансляция включает 3 этапа: инициация, элонгация, терминация. 5. Процессинг белка -Это совокупность изменений в структуре белка, которые заканчиваются формированием структурно и функционально зрелой белковой молекулы.он может быть 2-х видов: а)котрансляционный, протекающий во время трансляции; б)посттрансляционный – химическая модификация белка происходит после трансляции. Рибосомы. Каждая рибосома состоит из малой и большой субъединиц. Содержит рРНК, а также около 80 различных белков, в том числе и ферментов. Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК. мРНК связывается с малой субъединицей рибосомы, когда происходит узнавание 3'-концом 16S рибосомной РНК комплементарной последовательности Шайн-Далгарно, расположенной на 5'-конце мРНК, а также позиционирование стартового кодона мРНК на малой субъединице. У эукариот малая субчастица рибосомы связывается также с помощью кэпа, на конце мРНК. Ассоциация малой и большой субъединиц происходит при связывании формилметионил-тРНК и участии факторов инициации. Таким образом, распознавание антикодона происходит на малой субъединице.
Регуляция биосинтеза белка на уровне репликации и транскрипции. Регуляция биосинтеза белка на этапе трансляции. Посттрансляционная модификация белков. Основные уровни регуляции биосинтеза: 1. Регуляция синтеза белка на стадии репликации. Регуляция возможна путем добавления (или удаления) кодирующих (или регуляторных) участков на ДНК. Если удалить матрицу , то и синтеза белка с нее не будет, а если увеличить дозу определенного гена в ДНК , то появится возможность ускорить построение белков на многих одинаковых матрицах. В большинстве случаев наличие избыточной генетической информации отрицательно сказывается на жизнеспособности клеток, а ее недостаток, возникающий из-за недорепликации ДНК, приводит к их гибели из-за отсутствия жизненно важных генов. 2. На уровне транскрипции.
Варианты: а)групповая репрессия генов белками – гистонами; б)амплификация генов - увеличение числа копий заданного участка ДНК или гена. в)регуляция сигналами-усилителями. Сигналы-усилители - энхансеры - выступающий участок ДНК, который может быть значительно удален от промотора. 3. регуляция на уровне трансляции: тотальная репрессия или активация трансляции при изменении активности и количества белковых факторов; избирательная дискриминация иРНК; механизм повышения эффективности трансляции включает образование полисом - это комплекс нескольких рибосом с одной иРНК. 4. Регуляция биосинтеза белков путем посттрансляционной модификации: приводила к образованию общей полипептидной цепи, разрезаемой в дальнейшем на индивидуальные белки специфическими протеиназами. Посттрансляционная модификация белков.Модификации происходят в ЭПС и аппарате Гольджи . Однако множество других ковалентных модификаций протекает в первую очередь именно в цитозоле. Некоторые из них стабильны и необходимы для активности белка. Посттрансляционные модификации включают в себя фосфорилирование факторов транскрипции протеинкиназами , гликозилирование, ацилирование, циклизацию, амидирование, гидроксилирование и метилирование различных остатков аминокислот. Многие из перечисленных модификаций являются критическими для биологической активности пептидов.
34. Теория оперонной регуляции транскрипции. Ф-ии и особые зоны промотора. В 1961 году при исследовании индукции синтеза фермента—β-галактозидазы, участвующего в расщеплении лактозы в клетках E. coli, было установлено следующее: когда клетки E. Coli растут на ср
Дата добавления: 2015-03-11; просмотров: 1644;
