Получение соляной кислоты синтетическим способом
Синтетический способ производства соляной кислоты настоящее время почти полностью вытеснил на заводах старый сульфатный способ получения этого технически важного продукта.
Исходными веществами для приготовления синтетической соляной кислоты служат водород и хлор, получаемые электролизом раствора хлористого натрия. Производство соляной кислоты по этому способу состоит из двух стадий: 1) получения хлористого водорода, 2) поглощения хлористого водорода водой.
Обе стадии производства легко осуществить в форме демонстрационного опыта на уроке. Хлор получают обычно заранее взаимодействием марганцево-кислого калия или двуокиси марганца с крепкой соляной кислотой и собирают его в газометре над насыщенным раствором хлористого натрия, в котором хлор мало растворим.
Хлор может быть также получен действием разбавленной соляной или серной кислоты па хлорную известь. Ток хлора регулируется посредством приливання из капельной воронки кислоты в колбу, содержащую хлорную известь. При проведении опыта не требуется нагревания.
Водород получают взаимодействием цинка с раствором серной кислоты в лабораторных газогенераторах типа аппарата Киппа, присоединяемых к основной установке через промывалку с концентрированной серной кислотой. Хлор и водород могут быть получены и электролитическим путем. Однако такой прием сильно усложняет всю установку, и вспомогательные приспособления затрудняют учащимся усвоение сущности главного процесса — синтеза хлористого водорода.
Общий вид установки для получения соляной кислоты синтетическим способом изображен на рис. 10. Сухой хлор поступает в узкую стеклянную трубку, вставленную в более широкую Т-образную трубку так, чтобы она несколько выступала над ее краями. Обе трубки скрепляются при помощи отрезка резиновой трубки.
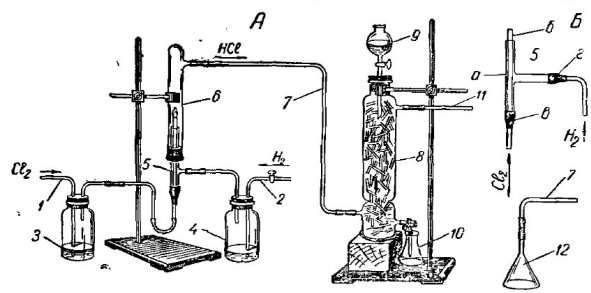
Рис. 10. Установка для получения соляной кислоты синтетическим способом. А. Общий вид: 1 — газоприводная трубка для хлора; 2—газоприводная трубка для водорода; 3 и 4 — промывные склянки с концентрированной серной кислотой; 5 — горелка для сжигания водорода в хлоре; 6 — камера для собирания хлористого водорода; 7—газоотводная трубка для хлористого водорода; 8 — поглотительная колонка с битым стеклом; 9—капельная воронка с водой; 10 — колба для собирания образующейся соляной кислоты; 11—газоотводная трубка к аспиратору (или водоструйному насосу).
Б. Детали установки: 5 — горелка для сжигания водорода в хлоре: а — тройник, б — узкая стеклянная трубка; в н г — резиновые трубки; 12 — стеклянная воронка (вместо камеры 6 для собирания хлористого водорода) с газоотводной трубкой 7
Такая горелка 5 вставляется вместе с корковой пробкой в стеклянный цилиндр 6. Свободный конец Т-образной трубки соединяется с промывалкой 4, содержащей концентрированную серную кислоту для осушки водорода. Образующийся в цилиндре (при реакции горения хлора в водороде или, наоборот,— водорода в хлоре) хлористый водород под действием водоструйного насоса поступает в нижнюю часть поглотительной колонки 8, где навстречу газу движется вода из -капельной воронки 9.
Так осуществляется противоток, обеспечивающий полноту поглощения хлористого водорода водой. Реакции, происходящей между этими веществами, способствует также увеличение поверхности соприкосновения. Для этого внутрь поглотительной колонки помещены кусочки битого стекла. При растворении хлористого водорода в воде получается соляная -кислота, которая время от времени выпускается в колбу 10, откуда берется проба для ее испытания (реакция с лакмусом, раствором азотнокислого серебра, металлическим магнием и др.).
Для приведения установки (рис. 10) в действие горелку вместе с пробкой вынимают из камеры 6 и пускают ток водорода (из аппарата Киппа, не изображенного на рисунке). После проверки чистоты водорода (проба на отсутствие гремучего газа) его поджигают у отверстия горелки б, и пламя регулируют так, чтобы оно горело спокойно и не было бы слишком большим. После этого горелку вместе с пробкой вводят в цилиндр и пускают слабый ток хлора из газометра (не изображенного на рисунке).
Водород подается в избытке, чтобы избежать попадания свободного хлора в продукт реакции. Пламя приобретает бледно-зеленую окраску, и камера наполняется белым туманом, который рассеивается после включения аспиратора или водоструйного насоса. Опыт заканчивают следующим образом: открывают камеру (вынимают пробку вместе с горелкой), прекращают ток хлора, а затем и водорода.
Уже через несколько минут таким путем удается получить раствор соляной кислоты достаточной концентрации и проделать с ним характерные реакции. Кроме этого, на уроке может быть определена концентрация полученного раствора соляной кислоты путем титрования его раствором щелочи известной концентрации в присутствии фенолфталеина. Зная титр щелочи (число граммов, содержащихся в 1 мл раствора), объем раствора щелочи, затраченной на нейтрализацию данного объема соляной кислоты, легко вычислить концентрацию кислоты.
При выполнении данного опыта (как и других опытов с водородом и ядовитыми газами) необходимо тщательно соблюдать меры предосторожности во избежание взрыва и отравлений.
Другой, более простой вариант этого же опыта состоит в том, что вместо камеры 6 (рис. 10) к газоотводной трубке 7 для хлористого водорода прикрепляют при помощи резиновой трубки обычную стеклянную воровку 12 под которую направляют пламя горелки 5 для сжигания хлоро-водородной смеси. Благодаря создаваемому аспиратором (или водоструйным насосом) разрежению ток хлористого водорода, образующегося под воронкой, направляется по трубке 7 в поглотительную колонку 8.
Между трубкой, отходящей от камеры, в которой происходит образование хлористого водорода, и поглотительной колонкой можно вставить тройник, к которому присоединена короткая резиновая трубка с зажимом. Открывая зажим на одно мгновение, легко обнаружить выделяющийся хлористый водород: подносят к нему стеклянную пластинку, смоченную раствором аммиака (образуется белый дым хлористого аммония), или влажную лакмусовую бумажку синего цвета (она становится красной).
Чтобы сделать опыт максимально безопасным, иногда рекомендуют поместить промывную склянку с водой между горелкой и поглотительной колонкой. Такая склянка служит затвором, предотвращающим возможность проникновения взрывчатой смеси водорода и воздуха в поглотительную колонку.
Для получения хлористого водорода вместо свободного водорода экономически выгодно использовать водород из воды. Взаимодействие хлора с водяными парами может быть выражено следующим уравнением:
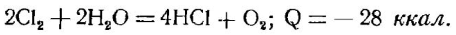
Эту эндотермическую реакцию легко осуществить на опыте, пропуская хлор и водяные пары над сильно нагретым катализатором. Последний готовят, пропитывая кусочки пемзы горячим концентрированным раствором хлорной меди, упариванием раствора и прокаливанием кусочков пемзы в фарфоровом тигле. Образующиеся продукты реакции — хлористый водород и кислород — испытывают, как обычно, производя с ними характерные реакции.
Обратная реакция — окисление хлористого водорода кислородом воздуха — протекает при нагревании в присутствии того же катализатора (процесс Дикона, применявшийся ранее для получения хлора).
Если пропускать хлор и водяные пары над раскаленным углем, то реакция идет и без катализатора. Она может быть выражена следующим суммарным уравнением:

Если процесс вести при очень высокой температуре, то наряду с двуокисью углерода получается еще и окись углерода.
Последний способ получения соляной кислоты представляет технический интерес, так как он не требует для своего осуществления водорода, на который современная промышленность предъявляет большой спрос (для синтеза аммиака, получения искусственной нефти и др.)
Дата добавления: 2023-01-03; просмотров: 8647;
