Разложение углекислого кальция
Обжиг углекислого кальция (в виде известняка, мела, мрамора и других минералов) представляет важную отрасль промышленности, вырабатывающую известь в качестве вяжущего строительного материала и химического продукта, а также двуокись углерода, используемую для получения соды и других веществ. Распад углекислого кальция выражается следующим уравнением эндотермической реакции:
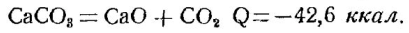
Процесс этот осуществляется в промышленности путем обжига минералов, содержащихся СаСО3 в» печах шахтного типа. Источником высокой температуры (около 800°) служит кокс или антрацит.
Воспроизведение этого процесса в качестве школьного демонстрационного опыта сопряжено с некоторыми техническими трудностями. Поэтому обжиг углекислого кальция производится обычно в упрощенном виде. С этой целью кусочек мрамора нагревают в тигельной или муфельной электрической печи, на что затрачивается несколько часов.
Обжиг известняка проводится также в самодельной трубчатой печи с внешним электронагревом. Трубку заполняют измельченным -мелом или мрамором. В последнем случае опыт можно провести количественно, сравнивая вес исходного вещества и образующейся окиси кальция. Полученный продукт испытывают водой. Происходит гашение извести, а образующийся раствор гидрата окиси кальция окрашивает раствор фенолфталеина в малиновый цвет.
Опыт может быть проведен и в течение одного урока. Небольшой кусочек мрамора в виде пластинки сильно прокаливают непосредственно в пламени газовой горелки (или спиртовки с приспособлением для продувания воздуха). Происходит частичное разложение углекислого кальция, что доказывается, как и в предыдущем случае, реакцией гидратации и испытанием полученного раствора фенолфталеине м.
Существенный недостаток обоих этих вариантов состоит в том, что он позволяет обнаружить лишь один продукт реакции—окись кальция, тогда как второй продукт— двуокись углерода при этом не улавливается. Вследствие этого учащиеся получают неполное представление о такой важной в техническом отношении реакции, как разложение углекислого кальция. Между тем разложение углекислого кальция весьма просто осуществить в течение нескольких минут с помощью электро-нагрева и обнаружить оба продукта реакции. Для этого можно применить установку, изображенную на рис. 9.
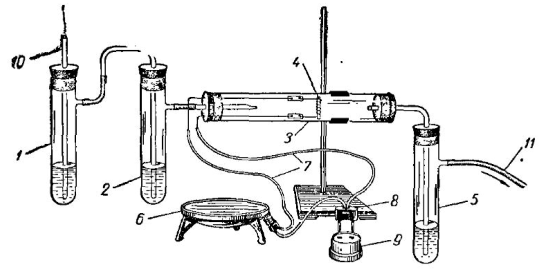
Рис. 9. Установка для разложения углекислого кальция: 1 — пробирка с раствором едкого натра; 2—пробирка с известковой водой; 3 — реакционная трубка с электроспиралью; 4—тонкий кусочек мрамора; 5 — пробирка с известковой водой; 6 — электроплитка (сопротивление) ; 7 — электропровода (изолированные); 8—вилка; 9 — розетка от электросети: 10 — газоприводная трубка (для воздуха); 11 — газоотводная трубка к водоструйному насосу или аспиратору
Существенная часть этой установки представляет собой реакционную трубку, внутри которой вставлен кусок спирали от электроплитки, как это было описано ранее. В пространство между витками спирали помещают кусочек мрамора. Через собранную установку продувают ток воздуха посредством аспиратора или водоструйного насоса. Воздух очищается от двуокиси углерода и поступает по трубке в пробирку 1, содержащую раствор щелочи.
Проходя в пробирке 2 через известковую воду, очищенный воздух не вызывает ее помутнения, на что необходимо обратить внимание учащихся. Затем включают электрический ток, и спираль накаляется докрасна. Через несколько минут известковая вода в про бирке 5 мутнеет вследствие образования карбоната кальция:
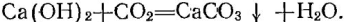
В пробирке же 2 известковая вода остается прозрачной. Двуокись углерода образовалась при разложении мрамора, помещенного между витками спирали. Электрический ток выключают, продолжая пропускать струю воздуха для более быстрого охлаждения спирали. Через несколько минут вынимают пробку и извлекают твердый остаток.
Он представляет собой белое рыхлое и хрупкое вещество, отличающееся от твердого кристаллического мрамора. Прибавление в дистиллированную воду, содержащую 1—2 капли фенолфталеина, продукта реакции вызывает появление малиновой окраски индикатора вследствие образования щелочи:
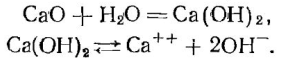
Исходное вещество — мрамор — нерастворимо и не реагирует с водой, и фенолфталеин не меняет своей окраски.
Таким образом, в течение нескольких минут может быть показано, что расход карбоната кальция представляет собой сильно эндотермическую реакцию и что продуктом этого распада являются два вещества — окись кальция и двуокись углерода, присутствие которых доказывается при помощи фенолфталеина и известковой воды.
Учитель химии Чжу Инь-фу (Китайская Народная Республика) в письме, присланном в адрес Академии педагогических наук РСФСР, предлагает использовать для разложения мрамора пламя гремучего газа. Мрамор помещают в широкую стеклянную трубку, в которую вводят кислородно-водородную горелку в виде двух узких стеклянных трубок, к концам которых припаяны куски фарфоровых трубок, поскольку они более тугоплавки, чем стеклянные.
В таком приборе можно показать, что распад углекислого кальция требует сильного нагревания и что при этом образуется окись кальция и углекислый газ, который легко и наглядно можно обнаружить (подобно тому, как это делается в приборе, изображенном на рис. 9).
Опыт продолжается всего лишь несколько минут, так как кислородно-водородное пламя дает очень высокую температуру.
При выполнении опыта с кислородно-водородным пламенем необходимо обращать самое серьезное внимание на меры предосторожности во избежание взрыва.
Описанные установки, способствуя уяснению химизма процесса, не дают представления об осуществлении его в промышленности. Чтобы восполнить этот пробел, рекомендуется показать учащимся схему (а также модель) известко-обжигательной печи.
Весьма полезно также продемонстрировать отдельные кадры из кинофильмов и диапозитивы. После предварительного освещения материала о производстве извести большую пользу учащимся принесет экскурсия на известко-обжиговый завод.
Дата добавления: 2023-01-03; просмотров: 8750;
