ТЕМА 4. ОРГАНИЧЕСКИЕ ВЕЩЕСТВА ЖИВЫХ ОРГАНИЗМОВ, ИХ РАЗНООБРАЗИЕ И БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
Первичная структура –последовательность аминокислотных остатков в полипептидной цепи.
Вторичная структура – спиралеобразная или складчатая упаковка полипептидной цепи, образующаяся благодаря возникновению водородных связей между атомами водорода NH-группы одного витка или слоя и атомами кислорода СО-группы другого витка или слоя.
Третичная структура – клубок (глобула), в который закручиватется полипептидная спираль или складчатая структура благодаря различным связям между радикалами аминокислотных остатков. Это могут быть следующие виды связей:
- ковалентные связи (между двумя остатками аминокислоты цистеина – дисульфидные мостики);
- ионные связи между противоположно заряженными радикалами;
- водородные связи;
- гидрофобные взаимодействия – при взаимодействии с окружающими молекулами воды белковая молекула сворачивается так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Четвертичная структуравозникает при объединении нескольких глобул. Например, молекула гемоглобина состоит из четырех соединенных глобул. Стабилизируется теми же типами связей, что и третичная. Бывает не у всех белков.
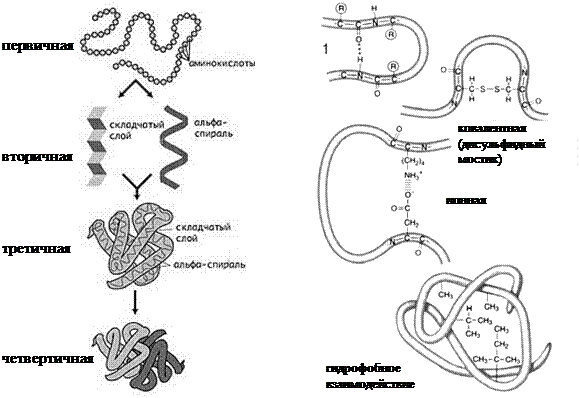

Структура белка Типы связей
В зависимости от химического состава белки разделяют на простые или протеины (состоят лишь из аминокислотных остатков) и сложные, или протеиды (содержат также небелковые компоненты). В частности, к сложным белкам относятся гликопротеиды (соединения с углеводами), липопротеиды (с липидами), нуклеопротеиды (с нуклеиновыми кислотами).
По форме молекул и свойствам различают белки:
- глобулярные –более или менеешаровидные, растворимы в воде;
- фибриллярные – нитевидные,нерастворимы воде;
- мембранные –пронизывают клеточную мембрану и закреплены в ней.
Как правило, белки достаточно стабильны в тех условиях (температура, pH и др.), в которых они в норме функционируют в организме. Резкое изменение этих условий приводит к денатурации белка.
Денатурацией белканазывают любые изменения в его биологической активности и/или физико-химических свойствах, связанные с потерей четвертичной, третичной или вторичной структуры. Денатурация бывает обратимой (в этом случае после прекращения воздействия вызвавших ее факторов происходит обратный процесс – ренатурация) и необратимой. Пример необратимой денатурации – приготовление куриного яйца, когда под воздействием высокой температуры растворимый в воде прозрачный белок овальбумин становится плотным, нерастворимым и непрозрачным. Процесс разрушения первичной структуры белков называют деструкцией, она всегда необратима.
Функции белков:
1. Структурная. Из белков построен внутренний скелет клеток – цитоскелет. Также они входят в состав всех клеточных органелл, мембран. В межклеточном веществе человека и животных структурную функцию выполняют белки коллаген и эластин. От содержания и расположения волокон этих белков в значительной мере зависят механические свойства тканей (твердость эластичность, упругость и т. п.). Белок кератин образует ногти, рога, копыта, клювы, волосы, иглы и т. п. Основой шелковых нитей и паутины служит белок фиброин.
2. Запасающая и энергетическая. Так называемые резервные белки запасаются в качестве источника энергии и вещества в семенах растений и яйцеклетках животных.
3. Каталитическая. Почти все биологические катализаторы – ферменты –являются белками (подробнее см. ниже).
4. Рецепторная. Обусловлена способностью воспринимать некоторыми белками различные химические и физические раздражители и посредством изменения формы своих молекул передавать их другим клеточным компонентам, которые вырабатывают тот или иной ответ. Этим обусловлено одно из основных свойств живого – раздражимость.
5. Регуляторная и сигнальная. Регуляторные белки регулируют активность различных внутриклеточных биохимических процессов, в том числе и синтез других белков. Они запускают и останавливают различные системы клетки по мере необходимости. Сигнальные белки осуществляют координаторную функцию на межклеточном уровне: обеспечивают передачу определенных химических (гуморальных) сигналов от одних клеток к другим. Белковую природу имеют некоторые гормоны, нейрогормоны, цитокины, факторы роста и др.
6. Транспортная. Гемоглобин разносит от легких по тканям кислород и в обратном направлении – углекислоту.Транспортные белки переносят липиды, синтезирующиеся на мембранах эндоплазматической сети, к другим органеллам. Белки, встроенные в плазматическую мембрану, обеспечивают транспорт веществ в клетку и из клетки наружу.
7. Двигательная.Моторные белки обеспечивают движения организма, перемещение клеток внутри организма (например, амебоидное движение лейкоцитов), движение ресничек и жгутиков, а также активный и направленный внутриклеточный транспорт. Например, белки актини миозин, входящие в состав мышечных клеток, обеспечивают их способность к сокращению.
8. Защитная функция белков многообразна. Структуры, в состав которых входят белки (наружный скелет членистоногих, кости, хрящевые образования), предотвращают повреждение тканей и органов. Белки защищают организмы от проникновения извне чужеродных веществ и болезнетворных микроорганизмов. Иммуноглобулины (или антитела) позвоночных животных – специализированные белки, способные распознать и обезвредить бактерии, вирусы, другие посторонние для организма структуры и вещества – антигены, воспринимаемые им как инородные. Они вызывают специфический иммунный ответ. Иммуноглобулинам присуща специфичность – определенное антитело образуется в ответ на поступление в организм того или иного антигена. Интерферон – это белок, который подавляет жизнедеятельность и размножение вирусов. Белки крови участвуют в процессах ее свертывания и образования тромбов, предотвращая кровопотери при повреждении стенок кровеносных сосудов. Защитную функцию могут выполнять некоторые ферменты, например лизоцим, который содержится в слюне, слизистых оболочках, слезной жидкости и обезвреживает различные болезнетворные агенты.
Подводя итоги вышесказанного, можно констатировать, что роль белков для живых организмов невозможно переоценить. Не случайно Энгельс определил жизнь как способ существования белковых тел.
IV. Ферменты –это биологические катализаторы.
Катализ – изменение скорости протекания химических реакций под действием определенных химических соединений. С участием фермента реакция осуществляется в 106–1012 раз быстрее, чем в среде без фермента. Чтобы в приемлемые сроки состоялась реакция без участия ферментов, нужны высокая концентрация реагирующих веществ в среде или повышенная температура, при которой ускоряется движение молекул и возрастает вероятность контактов молекул реагирующих соединений. Но в организмах концентрация веществ часто очень низкая, а высокие температуры для них опасны. Именно поэтому биохимические реакции не могут происходить без участия ферментов. Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества — продуктами.
Ферменты бывают простыми и сложными. Простые ферменты – это белковые молекулы, состоящие лишь из аминокислотных остатков (пепсин, трипсин и т. п.). Сложные ферменты, кроме белковой части, содержат еще и небелковую, которую называют кофактором. Кофакторами могут быть неорганические катионы или анионы. Органические кофакторы, прочно связанные с ферментом, называют также простетическими группами. Кофакторы органической природы, способные отделяться от фермента, называют коферментами. Белковый компонент определяет, какую именно реакцию катализирует данный сложный фермент. Активность сложных ферментов проявляется лишь тогда, когда их белковая и небелковая части соединены.
Каталитическая активность фермента определена не всей его молекулой, а лишь ее небольшим участком – активным центром. Его пространственная структура отвечает химическому строению субстрата. Именно поэтому действие фермента специфично. В одной молекуле фермента может быть несколько активных центров.
Ферменты образуют неустойчивые комплексы с субстратами. При контакте с ферментом субстрат, вступающее в реакцию, располагается в непосредственной близости к специфическим группам его активного центра. При этом уменьшается стабильность химических связей в молекуле субстрата. Известно, что для начала химической реакции необходима определенная энергия, названная энергией активации. Образовавшийся комплекс «фермент – субстрат» снижает энергию активации. Такой комплекс быстро распадается с образованием продуктов реакции. Сам фермент при этом не теряет своей активности и может катализировать следующую подобную реакцию.
Одни ферменты обеспечивают расщепление, другие – синтез определенных веществ. Например, фермент обеспечивает расщепление (гидролиз) целлюлозы, амилаза – гидролиз крахмала.
Активность фермента проявляется лишь в определенных условиях (температура, давление, рН и т. п.). Существуют также вещества, способные снижать активность ферментов – ингибиторы.
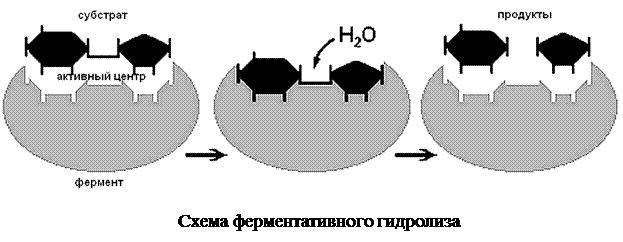 Ферментативные реакции происходят в виде ряда (до нескольких десятков) последовательных этапов, каждый из которых катализируется определенным ферментом. Цепи взаимосвязанных ферментативных реакций обеспечивают обмен веществ и превращение энергии в отдельных клетках и организме в целом.
Ферментативные реакции происходят в виде ряда (до нескольких десятков) последовательных этапов, каждый из которых катализируется определенным ферментом. Цепи взаимосвязанных ферментативных реакций обеспечивают обмен веществ и превращение энергии в отдельных клетках и организме в целом.
Литература:
Балан П.Г. Биология: Учебн. для общеобразоват. учебн. заведений: уровень стандарта, академический уровень / П.Г.Балан, Ю.Г.Верес,В.П.АПолищук; пер. с укр. – к,:Генеза, 2010. С. 41-58.
ТЕМА 4. ОРГАНИЧЕСКИЕ ВЕЩЕСТВА ЖИВЫХ ОРГАНИЗМОВ, ИХ РАЗНООБРАЗИЕ И БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
ЛЕКЦИЯ 2. НУКЛЕИНОВЫЕ КИСЛОТЫ, АТФ, БИОЛОГИЧЕСКИ АКТИВНЫЕ ВЕЩЕСТВА
План
I. Общие сведения о строении нуклеиновых кислот.
II. РНК
III. ДНК
IV. АТФ
V. Биологически активные вещества.
I. Нуклеиновые кислоты – сложные высокомолекулярные биополимеры, мономерами которых являются нуклеотиды (от 200 до 200 млн.) Вначале нуклеиновые кислоты обнаружили в ядре клеток, откуда и происходит название этих соединений (от лат. нуклеус – ядро). Но позже эти вещества нашли и в других частях клетки.


Молекула нуклеотида состоит из трех частей: остатков азотистого основания, пятиуглеродного моносахарида (пентозы) и фосфорной кислоты. В зависимости от вида пентозы в составе нуклеотида различают два типа нуклеиновых кислот: дезоксирибонуклеиновую (ДНК) и рибонуклеиновые (РНК). В состав ДНК входит остаток дезоксирибозы, а РНК – рибозы.
В состав нуклеотидов ДНК входят остатки следующих азотистых оснований: аденин (сокращенно обозначается буквой А), тимин (Т), гуанин (Г), цитозин (Ц). В состав РНК вместо тимина входит уроцил.
II. Молекулы РНК клеток прокариот и эукариот состоят из одной цепи Существуют три основных типа РНК:
1. Информационная, или матричная, РНК (иРНК, или мРНК) представляет собой копию определенного участка молекулы ДНК. Такая молекула переносит наследственную информацию от ДНК к месту синтеза полипептидной цепи, а также непосредственно участвует в ее сборке.
2. Транспортная РНК (тРНК)имеет наименьшие размеры среди всех РНК (70–90 нуклеотидов). Количество видов тРНК соответствует количеству видов аминокислот. тРНК определенного вида присоединяет к себе определенную аминокислоту и транспортирует ее к месту синтеза белка. Там комплекс тРНК она «узнает» соответствующий участок иРНК, состоящий из 3 нуклеотидов, кодирующий данную аминокислоту (кодон), после чего подсоединяет принесенную аминокислоту к полипептидной цепочке, а сама удаляется за новой. Таким образом, тРНК и иРНК принимают непосредстенное участие в процессе матричного биосинтеза белка (будет подробнее рассмотрен в соответствующем разделе).
3. Рибосомальная РНК (рРНК) входит в состав особых органелл клетки – рибосом. Вместе с белками она выполняет структурную функцию, обеспечивая определенное пространственное расположение иРНК и тРНК во время биосинтеза белковой молекулы. Кроме того, участвуя в образовании пептидных связей молекулы синтезируемого белка, рРНК выполняет также каталитическую функцию, являясь так называемым рибозимом (ферментом небелковой природы). В клетках эукариот рРНК синтезируется в ядрышке.
Молекулы РНК в клетки находятся как в ядре, так и в цитоплазме, в различных органоидах.
III. Молекулы ДНК в клетках эукариот находятся в ядре, пластидах и митохондриях. Расшифровка структуры ДНК имеет свою историю. В 1950 году Эрвин Чаргафф и его коллеги обнаружили такие количественные закономерности содержания азотистых оснований в молекуле ДНК (правила Чаргаффа):
1) количество нуклеотидов, содержащих аденин в любой молекуле ДНК, равно числу нуклеотидов, содержащих тимин (А = Т), а число нуклеотидов с гуанином – числу нуклеотидов с цитозином (Г = Ц);
2) сумма нуклеотидов с аденином и гуанином равна сумме нуклеотидов с тимином и цитозином (А+Г = Т+Ц).
Это открытие способствовало установлению Уотсоном и Криком в 50-х годах ХХ века пространственной структуры молекулы ДНК.
Молекула ДНК состоит из двух цепей нуклеотидов, которые соединены между собой с помощью водородных связей. Эти связи возникают между двумя нуклеотидами, которые как бы дополняют друг друга по размерам. Установлено, что остаток аденина (А) нуклеотида одной цепи молекулы ДНК всегда соединяется с остатком тимина (Т) нуклеотида другой цепи (между ними возникают две водородные связи), а гуанина (Г) – с цитозином (Ц) (между ними возникают три водородные связи). Это четкое соответствие нуклеотидов в двух цепях ДНК имеет название комплементарность.


При этом отдельные нуклеотиды соединены между собой в цепь за счет особой ковалентных связей, образующихся между остатком углевода одного нуклеотида и остатком фосфорной кислоты другого. Определенная последовательность остатков нуклеотидов, расположенных в виде двойной цепи, - первичная структура ДНК.
Две цепи нуклеотидов обвивают друг друга, создавая закрученную вправо спираль диаметром приблизительно 2 нанометра – вторичная структура ДНК.
Молекулы ДНК в клетке образуют компактные структуры. Например, длина ДНК наибольшей хромосомы чело века составляет 8 см, но она свернута таким образом, что вмещается в хромосоме длиной всего 5 мкм. Это происходит благодаря тому, что двойная спираль ДНК пространственно уплотняется, формируя третичную структуру – суперспираль. Такое строение характерно для ДНК хромосом эукариот и обусловлено взаимодействием между ДНК и ядерными белками. В клетках прокариот молекула ДНК не вступает в комплекс с белками и имеет форму кольца.
Свойства ДНК.Подобно белкам, под действием определенных факторов молекулы ДНК способны к денатурации, ренатурации и деструкции. Важное свойство молекул ДНК – их способность к самоудвоению - репликации. Оно основывается на принципе комплементарности: последовательность нуклеотидов во вновь созданной цепи определяется их расположением в цепи материнской молекулы ДНК, которая служит матрицей.
Репликация ДНК – полуконсервативный процесс, то есть две дочерние молекулы ДНК содержат по одной цепи, унаследованной от материнской.
Схож с репликацией процесс транскрипции: при нем на матрице ДНК синтезируется по принципу комприментарности РНК с определенной последовательностью. Только вместо тимина положение, комплементарное аденину матрицы, занимает уроцил. Репликация и транскрипция осуществляются при участии определенных ферментов.
Функция ДНК – сохранение, воспроизведение и передача наследственной информации. В структуре ДНК закодировано строение белков. Этот код воспроизводится при посредничестве иРНК. Также в ДНК закодирована структура других типов РНК, не кодирующих напрямую структуру белка, но принимающих участие в его синтезе (тРНК, рРНК).
Единицей наследственности всех организмов является ген – участок молекулы ДНК (у некоторых вирусов – РНК), который несет наследственную информацию о структуре определенного белка или нуклеиновой кислоты. Один ген кодирует одну полипептидной цепи белка либо одну молекулу РНК. Совокупность генетической информации, закодированной в генах определенной клетки или целостного организма, называется геномом. Это интегрированная система, в которой отдельные гены взаимодействуют между собой.
Количество генов у различных организмов значительно колеблется. В целом, чем более сложно организован организм, тем больше генов в его клетках. Однако далеко не вся ДНК в клетках несет генетическую информацию. В некоторых случаях неинформационные (некодирующие) участки молекулы ДНК могут составлять 80–90 %, тогда как кодирующие структуру белков или РНК – только 10–20 %. Функции некодирующих участков изучены недостаточно. Лишь для некоторых из них установлена регуляторная или структурная функция (учувствуют в компактизации ДНК, движении хромосом и т. д.).
Фрагменты ДНК могут перемещаться из одного участка молекулы в другой, изменяя тем самым функции определенных генов. В частности этот процесс происходит в иммунных клетках человека, благодаря чему они способны образовывать антитела специфичные к определенным антигенам.
Поврежденные молекулы ДНК способны к восстановлению при помощи определенных ферментов, этот процесс называется репарацией. Но система репарации полностью справляется со своей задачей далеко не всегда, в результате чего возникают изменения генома – мутации, служащие источником наследственной изменчивости.
IV. Аденозинтрифосфорная кислота (АТФ) по своему составу является нуклеотидом. Молекула АТФ состоит из остатков азотистого основания (аденина), пентозы (рибозы) и трех остатков фосфорной кислоты. АТФ имеет необычные для других органических соединений химические связи и свойства. Это две высокоэнергетические (макроэргические) химические связи между последовательно расположенными остатками фосфорной кислоты, в которых запасено значительное количество энергии. Если при участии соответствующего фермента отщепляется один остаток фосфорной кислоты, то АТФ превращается в аденозиндифосфорную кислоту (АДФ), при этом освобождается около 40 кДж энергии. Если от полученной молекулы АДФ опять отщепляется остаток фосфорной кислоты, она превращается в аденозинмонофосфорную кислоту (АМФ), при этом выделяется еще около 40 кДж энергии. Соответственно, при присоединении каждого остатка фосфорной кислоты запасается примерно по 40 кДж энергии. Таким образом молекулы АТФ служат универсальным химическим аккумулятором энергии в клетках.
Энергия, которая высвобождается в процессе расщепления молекул АТФ, используется для синтеза необходимых организму соединений, поддержания определенной температуры тела, обеспечения других процессов жизнедеятельности. Реализуется этот процесс путем взаимодействия молекул АТФ с ферментами, для которых они служат активаторами.
V. Биологически активные вещества – это органические соединения разной химической природы, способные влиять на обмен веществ и превращения энергии в живых существах. Одни из них регулируют процессы
метаболизма, роста и развития организмов, другие служат средством влияния на особей своего или других видов. К биологически активным веществам относят ферменты, витамины, гормоны, нейрогормоны, факторы роста, фитогормоны, антибиотики и т. п.
1. Витамины – низкомолекулярные органические соединения различной химической природы, необходимые для обеспечения процессов жизнедеятельности всех живых организмов. Витамины участвуют в обмене веществ и превращении энергии в основном в качестве компонентов сложных ферментов. Суточная потребность человека в витаминах составляет миллиграммы, а иногда и микрограммы. Известно приблизительно 20 разных витаминов и витаминоподобных соединений.
Основной источник витаминов для человека – продукты питания. Некоторые витамины в незначительном количестве синтезируются в организмах человека и животных из веществ-предшественников – провитаминов (так, витамин D образуется в коже человека под воздействием ультрафиолетового облучения) или симбиотическими микроорганизмами (в частности, в кишечнике человека бактерии синтезируют витамины К, В6, В12).
Когда еще не были известны химическое строение и механизм действия витаминов, их помечали буквами латинского алфавита – А, В, С, D др. Теперь применяют и химические названия (например, витамин С акже называют аскорбиновой кислотой). Витамины делят на две группы: водорастворимые (группа В, С и др.) и жирорастворимые (А, D, К, Е).
При недостатке определенных витаминов, их полном отсутствии, а также избытке развиваются опасные для здоровья человека и животных заболевания. Например, при недостатке определенных витаминов в организме возникает гиповитаминоз, при их полном отсутствии – авитаминоз, а при избытке – гипервитаминоз (например, избыточное содержание витамина А в организме человека, превышающее норму в 20–30 раз, вызывает отравление). Явления гипо- и авитаминоза могут проявляться и в результате нарушения обмена веществ. Это так называемая вторичная витаминная недостаточность, связанная с невосприятием организмом определенных витаминов.
2. Гормоны – органические вещества, регулирующие процессы обмена веществ и превращений энергии в организме животных и человека. Их производят железы внутренней и секреции (эндокринные железы). Именно секреция в специфических анатомических образованиях отличает гормоны от других регуляторных веществ, которые секретируются отдельными клетками, не оформленными в виде желез. К последним относят, в частности, нейрогормоны –вещества синтезирующиеся в некоторых нервных клетках, и потом поступающие в кровь(например, вазопрессин и окситоцин синтезируются в клетках мозга, оттуда поступают в эндокринную железу гипофиз, а уже из нее – в кровоток). Механизмы действия различных гормонов и нерогоромнов очень сильно различаются, но их объединяет общая функция: регуляция жизнедеятельности на уровне всего организма. Под контролем гормонов и нейрогормонов происходят все этапы индивидуального развития человека и животных и все процессы их жизнедеятельности. Если определенные гормоны производятся в недостаточном количестве или не производятся вообще, наблюдают нарушения развития и обмена веществ разной степени тяжести. Избыточная выработка определенных гормонов также негативно влияет на организм. Так, при недостаточном образовании в организме ребенка гормона роста развивается карликовость,а при избыточном – гигантизм.
По сравнению с работой нервной системы, которая обеспечивает передачу сигналов на значительные расстояния за короткое время, действие гормонов отличается меньшей скоростью, но производит более длительный эффект. Характерные особенности действия гормонов и нейрогормонов: дистанционность, высокие биологическая активность и специфичность действия, короткое время существования.
3. Нейромедиаторы – биологически активные вещества, которые обеспечивают межклеточные взаимодействия в нервной системе. В частности, они участвуют в передаче нервного импульса между двумя нейронами или между нейроном и мышечной клеткой. Их производят нервные и рецепторные клетки. Молекулы медиатора выделяются в пространство синаптической щели. Роль медиаторов могут исполнять различные вещества: ацетилхолин, норадреналин, и др. Гормон адреналин также выполняет функцию нейромедиатора.
4. Факторы роста клетки – полипептиды, стимулирующие или подавляют деление, дифференциацию, подвижность, метаболизм, другие проявления жизнедеятельности и гибель клеток. В отличие от гормонов, факторы роста продуцируют неспециализированные клетки, которые можно встретить во всех тканях.
5. Фитогормоны – регуляторные вещества растений, аналогичные по функциям гормонам животных. Однако по химической природе не имеют с последними ничего общего, так как возникли в ходе эволюции совершенно независимо. В отличие от животных, растения не имеют специальных органов, синтезирующих гормоны; вместе с тем отмечается большая насыщенность гормонами некоторых органов по сравнению с другими. Так, ауксинами богаче всего верхушечные меристемы стебля, гиббереллинами — листья, цитокининами — корни и созревающие семена. Фитогормоны обладают широким спектром действия. Фитогормоны регулируют многие процессы жизнедеятельности растений: прорастание семян, рост, дифференциацию тканей и органов, цветение, созревание плодов и т. п. Образуясь в одном органе (или его части) растения, фитогормоны обычно транспортируются в другой (или его часть).
6. Фитонциды— образуемые растениями биологически активные вещества, убивающие или подавляющие рост и развитие бактерий, микроскопических грибов, простейших. Характерными представителями фитонцидов являются эфирные масла, извлекаемые из растительного сырья промышленными методами.
7. Феромооны – продукты внешней секреции, выделяемых некоторыми видами животных и растений обеспечивающих химическую коммуникацию между особями одного вида. Если гормоны обеспечивают регуляцию на организменном уровне организации, то феромоны – на популяционно-видовом.
Приведенный выше список разновидностей биологически активных веществ далеко не полон, кроме того взгляды различных авторов, на их классификацию очень сильно разнятся. Само определение биологически активных веществ не позволяет установить сколько-нибудь четкие рамки для круга относящихся к ним соединений.
Литература:
Балан П.Г. Биология: Учебн. для общеобразоват. учебн. заведений: уровень стандарта, академический уровень / П.Г.Балан, Ю.Г.Верес,В.П.АПолищук; пер. с укр. – к,:Генеза, 2010. С. 58 – 70.
| <== предыдущая лекция | | | следующая лекция ==> |
| Структурные уровни организации белков | | | ТЕМА 6. ЦИТОПЛАЗМА КЛЕТКИ, ЕЁ КОМПОНЕНТЫ |
Дата добавления: 2014-12-15; просмотров: 1891;
