Структурные уровни организации белков
4. Солод В.И., Зайков В.И., Первов К.М. Горные машины и комплексы.- М.: Недра, 1981.-360с.
5. Топорков А.А. Машинист горновыемочных машин.- М.: Недра, 1991.-335с.
ТЕМА 4. ОРГАНИЧЕСКИЕ ВЕЩЕСТВА ЖИВЫХ ОРГАНИЗМОВ, ИХ РАЗНООБРАЗИЕ И БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
ЛЕКЦИЯ 1. ЛИПИДЫ, УГЛЕВОДЫ, БЕЛКИ
План
I. Липиды
II. Углеводы
III. Белки
IV.Принципы действия ферментов, их роль в жизнедеятельности организмов.
Органическими соединениями называют вещества, образованные атомами углерода, соединенными ковалентными связями. Содержание органических соединений в клетках составляет в среднем 20–30%. По количественному содержанию в живых организмах преобладают три класса органических веществ: белки, углеводы и липиды.
I. Липиды. В настоящее время не существует единого общепринятого определения липидов, равно как и четких границ данного класса. Традиционно в биологии к липидам относят различные гидрофобные и амфифильные органические соединения, практически не растворимые в воде и хорошо растворимые в неполярных растворителях (бензол, ацетон, хлороформ), содержащиеся в живых организмах. По своей структуре липиды делятся на две больших группы: простые и сложные.
Молекула простого липидасостоит из атомов углерода, водорода и кислорода. Обычно простыми липидами называют сложные эфиры жирных кислот с различными спиртами. Иногда в эту категорию относят также сами жирные кислоты, жирные альдегиды, жирные спирты, предельные углеводороды с длинной цепочкой и др., либо же эти вещества вообще исключают из класса липидов. Рассмотрим некоторые виды простых липидов, играющие наиболее важную роль в живых организмах:
1. Жиры– сложные эфиры, образованные трехатомным спиртом глицерином и тремя остатками жирных кислот. Они откладываются в виде включений в растительных и животных клетках. Повышенное содержание жиров (до 90 %) характерно для клеток почек, подкожной клетчатки позвоночных. У некоторых растений (подсолнечника, грецкого ореха, маслин и др.) много жиров содержится в семенах и плодах. Основные функции жиров:
- запасающая – в молекулах жиров запасается и хранится энергия; при полном окислении 1 г жира выделяется около 9 ккал энергии;кроме того, в процессе реакции выделяется вода, то есть, в виде жира можно запасать воду, что важно для животных пустынь, например, верблюдов.
- защитная –подкожная жировая клетчатка защищает внутренние органы животных и человека от механических повреждений и от избыточной потери тепла (теплоизоляционная функция). Последняя особенно важна для млекопитающих, обитающих в холодных морях (киты, тюлени).
2. Воски —сложные эфиры высших жирных кислот и высших высокомолекулярных спиртов. Иногда к воскам относят и другие соединения близкие по физико-механическим свойствам. Выделяются покровными тканями наземных животных и растений. Важнейшая функция восков – обеспечение водонепроницаемости покровов. Восковой слой задерживает не только жидкую воду (например, секрет копчиковой железы, которым водоплавающие птицы смазывают перья, чтобы они не намокали), но и предотвращает излишнее испарение воды из тела, которое могло бы привести к фатальному обезвоживанию (например, заселение членистоногими сухих местообитаний стало возможным только после появления в их покровах тонкого внешнего воскового слоя, аналогичный слой имеют высшие растения). Отдельно следует упомянуть использование восков пчелами как строительного материала для гнезд.
Сложные липиды — липиды, включающие в свою структуру помимо углерода, водорода и кислорода другие химические элементы. Чаще всего: фосфор, серу, азот.
1. Фосфолипиды содержат, помимо жирных кислот и спирта, остаток фосфорной кислоты. В их состав часто также входят азотистые основания и другие компоненты. Фосфолипиды – важнейший структурный элемент клеточных мембран.
2. Гликолипиды образуются в результате соединения липидов с углеводами. Как и фосфолипиды, обладают амфифильностью и входят в состав клеточных мембран. Преимущественно локализуются преимущественно на наружной поверхности плазмолеммы, где их углеводные компоненты входят в число других углеводов клеточной поверхности, благодаря чему могут участвовать в межклеточных взаимодействиях и контактах.
3. Стероиды – полициклические липиды, производные холестерина. Холестерин входит с состав плазмолеммы всех эукариотических организмов, стабилизирует ее фосфолипидный бислой. Многие стероиды являются гормонами человека и животных, то есть выполняют регуляторную функцию.
Таким образом, липиды в живых организмах выполняют запасающую, защитную (включая теплоизоляционную), структурную и регуляторную функции.
II.Углеводы(сахара) — органические вещества, содержащие карбонильную группу и несколько гидроксильных групп. В клетках животных углеводы содержатся в незначительных количествах (до 5 % сухой массы), а в растительных клетках их значительно больше (до 90 %). Выделяют следующие виды углеводов:
1. Моносахариды – простейшие углеводы, не гидролизующиеся с образованием более простых углеводов. Хорошо растворимы в воде, имеют сладкий вкус. Они могут содержать от 3 до 10 атомов углерода: триозы (3 атома углерода), тетрозы (4), пентозы (5), гексозы (6) и так далее до дексоз (10). Примерами гексоз являются глюкоза и фруктоза, пентоз – рибоза и дезоксирибоза (их остатки входят в состав нуклеиновых кислот: РНК и ДНК соотвественно).
2. Олигосахариды – углеводы, молекулы которых синтезированы из 2 — 10 остатков моносахаридов, соединённых ковалентными гликозидными связями. Соответственно различают: дисахариды, трисахариды и так далее. Например, сахароза (тростниковый, или свекловичный сахар) – дисахарид, состоящий из одного остатка глюкозы и одного остатка фруктозы. Имеют сладкий вкус, хорошо растворимы в воде. Под воздействием ферментов гидролизуют до моносахаридов.
3. Полисахариды – биополимеры, молекулы которых состоят из десятков, сотен или тысяч мономеров, которыми выступают остатки моносахаридов (одного или разных). Молекулярная масса некоторых из них может достигать нескольких миллионов а. е. м. Полисахариды отличаются друг от друга не только составом мономеров, но также длиной и степенью разветвленности цепей. Так, крахмал, целлюлоза и гликоген состоят из остатков глюкозы, но расположение их различно, в связи с чем указанные полисахариды имеют совершенно разные физико-химические свойства.
Углеводы могут вступать в связь с другими соединениями. Примеры: гликопротеиды (соединения углеводов с белками), гликолипиды (соединения углеводов с липидами).
Функции углеводов:
1. Запасающая и энергетическая. В клетках растений накапливается крахмал, животных и грибов – гликоген. Эти запасные соединения являются резервом питательных веществ и энергии. По мере необходимости эти вещества гидролизуются до глюкозы, которая окисляется в процессе дыхания. При окислении 1 грамма углеводов выделяются 4,1 ккал энергии и 0,4 г воды. Также глюкоза может расщепляться с выделением энергии и без участия кислорода – гликолиз.
2. Пластическая – остатки углеводов входят в состав сложных молекул (например, рибоза и дезоксирибоза участвуют в построении АТФ, ДНК и РНК).
3. Структурная (опорная) – участвуют в построении различных опорных структур. Так целлюлоза является основным структурным компонентом клеточных стенок растений, хитин выполняет аналогичную функцию у грибов, а также обеспечивает жёсткость экзоскелета членистоногих. В состав надмембранных структур клеток животных (гликокаликса) входят углеводы, обеспечивающие прочное соединение клеток между собой.
4. Осморегуляторная – углеводы участвуют в регуляции осмотического давления в организме. Например, содержание углеводов в соке вакуолей растительных клеток обеспечивает их упругое состояние – тургор.
5. Рецепторная – олигосахариды входят в состав клеточных рецепторов.
6. Защитная – полисахариды пектины способны связывать некоторые токсины и радионуклиды, мукополисахарид гепарин предотвращает свертывание крови, учувствует в иммунном ответе и др.
7. Входят в состав смазывающих жидкостей и слизей (см. функции воды).
III. Белки. Среди органических соединений белки играют ведущую роль. Они часто преобладают в клетках и в количественном соотношении: например, в клетках животных составляют до 40–50 % сухой массы, растений – до 20–35 %.
Белки – высокомолекулярные азотсодержащие биополимеры, мономерами которых являются остатки аминокислот.
Аминокислоты – это органические кислоты, содержащие аминогруппу(–NH2), которой присущи щелочные свойства, и карбоксильную группу (–СООН) с кислотными свойствами. Между собой аминокислоты различаются специфической частью – радикалом.
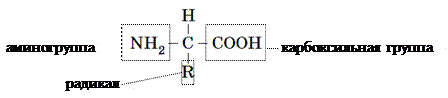

В организмах живых существ обнаружено свыше 100 аминокислот, но в состав белков в подавляющем большинстве случаев входят лишь 20 из них. Молекула каждого определенного белка характеризуется специфическими составом и последовательностью аминокислотных остатков, которые определяют неповторимость ее функциональных свойств. Аминокислоты делят на заменимые и незаменимые. Заменимые аминокислоты способны синтезироваться в организмах человека и животных. Незаменимые аминокислоты в организмах человека и животных не образуются, а поступают вместе с пищей. Их синтезируют растения, грибы или бактерии. Следует отметить, что для разных видов животных набор незаменимых аминокислот неодинаков, к тому же он может меняться с возрастом. Например, аргинин или гистидин – заменимые для взрослых и незаменимы для детей.
Остатки молекул аминокислот в составе белков соединены между собой крепкой ковалентной связью, которая возникает между карбоксильной группой одной аминокислоты и аминогруппой другой. Этот связь называют пептидной. Так образуется соединение, состоящее из остатков двух аминокислот, – дипептид. Структуры, которые состоят из большого количества остатков аминокислот (свыше 50), относятся к полипептидам(пептидная связь обозначена цветом):
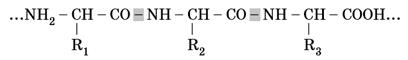
Полипептиды с высокой молекулярной массой (от 6000 до нескольких миллионов) называют белками. Они состоят из одной или нескольких полипептидных цепей и могут содержать до нескольких тысяч аминокислотных остатков.
Структурные уровни организации белков
Первичная структура –последовательность аминокислотных остатков в полипептидной цепи.
Вторичная структура – спиралеобразная или складчатая упаковка полипептидной цепи, образующаяся благодаря возникновению водородных связей между атомами водорода NH-группы одного витка или слоя и атомами кислорода СО-группы другого витка или слоя.
Третичная структура – клубок (глобула), в который закручиватется полипептидная спираль или складчатая структура благодаря различным связям между радикалами аминокислотных остатков. Это могут быть следующие виды связей:
- ковалентные связи (между двумя остатками аминокислоты цистеина – дисульфидные мостики);
- ионные связи между противоположно заряженными радикалами;
- водородные связи;
- гидрофобные взаимодействия – при взаимодействии с окружающими молекулами воды белковая молекула сворачивается так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Четвертичная структуравозникает при объединении нескольких глобул. Например, молекула гемоглобина состоит из четырех соединенных глобул. Стабилизируется теми же типами связей, что и третичная. Бывает не у всех белков.
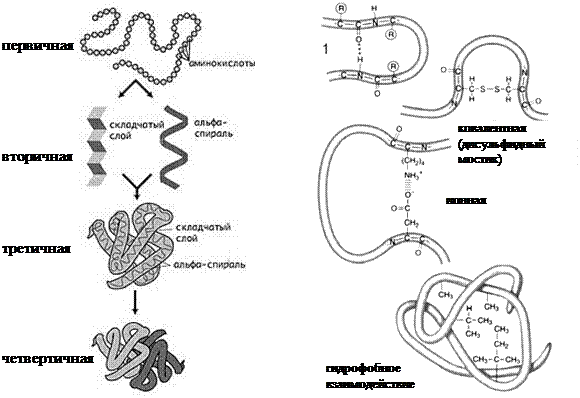

Структура белка Типы связей
В зависимости от химического состава белки разделяют на простые или протеины (состоят лишь из аминокислотных остатков) и сложные, или протеиды (содержат также небелковые компоненты). В частности, к сложным белкам относятся гликопротеиды (соединения с углеводами), липопротеиды (с липидами), нуклеопротеиды (с нуклеиновыми кислотами).
По форме молекул и свойствам различают белки:
- глобулярные –более или менеешаровидные, растворимы в воде;
- фибриллярные – нитевидные,нерастворимы воде;
- мембранные –пронизывают клеточную мембрану и закреплены в ней.
Как правило, белки достаточно стабильны в тех условиях (температура, pH и др.), в которых они в норме функционируют в организме. Резкое изменение этих условий приводит к денатурации белка.
Денатурацией белканазывают любые изменения в его биологической активности и/или физико-химических свойствах, связанные с потерей четвертичной, третичной или вторичной структуры. Денатурация бывает обратимой (в этом случае после прекращения воздействия вызвавших ее факторов происходит обратный процесс – ренатурация) и необратимой. Пример необратимой денатурации – приготовление куриного яйца, когда под воздействием высокой температуры растворимый в воде прозрачный белок овальбумин становится плотным, нерастворимым и непрозрачным. Процесс разрушения первичной структуры белков называют деструкцией, она всегда необратима.
Функции белков:
1. Структурная. Из белков построен внутренний скелет клеток – цитоскелет. Также они входят в состав всех клеточных органелл, мембран. В межклеточном веществе человека и животных структурную функцию выполняют белки коллаген и эластин. От содержания и расположения волокон этих белков в значительной мере зависят механические свойства тканей (твердость эластичность, упругость и т. п.). Белок кератин образует ногти, рога, копыта, клювы, волосы, иглы и т. п. Основой шелковых нитей и паутины служит белок фиброин.
2. Запасающая и энергетическая. Так называемые резервные белки запасаются в качестве источника энергии и вещества в семенах растений и яйцеклетках животных.
3. Каталитическая. Почти все биологические катализаторы – ферменты –являются белками (подробнее см. ниже).
4. Рецепторная. Обусловлена способностью воспринимать некоторыми белками различные химические и физические раздражители и посредством изменения формы своих молекул передавать их другим клеточным компонентам, которые вырабатывают тот или иной ответ. Этим обусловлено одно из основных свойств живого – раздражимость.
5. Регуляторная и сигнальная. Регуляторные белки регулируют активность различных внутриклеточных биохимических процессов, в том числе и синтез других белков. Они запускают и останавливают различные системы клетки по мере необходимости. Сигнальные белки осуществляют координаторную функцию на межклеточном уровне: обеспечивают передачу определенных химических (гуморальных) сигналов от одних клеток к другим. Белковую природу имеют некоторые гормоны, нейрогормоны, цитокины, факторы роста и др.
6. Транспортная. Гемоглобин разносит от легких по тканям кислород и в обратном направлении – углекислоту.Транспортные белки переносят липиды, синтезирующиеся на мембранах эндоплазматической сети, к другим органеллам. Белки, встроенные в плазматическую мембрану, обеспечивают транспорт веществ в клетку и из клетки наружу.
7. Двигательная.Моторные белки обеспечивают движения организма, перемещение клеток внутри организма (например, амебоидное движение лейкоцитов), движение ресничек и жгутиков, а также активный и направленный внутриклеточный транспорт. Например, белки актини миозин, входящие в состав мышечных клеток, обеспечивают их способность к сокращению.
8. Защитная функция белков многообразна. Структуры, в состав которых входят белки (наружный скелет членистоногих, кости, хрящевые образования), предотвращают повреждение тканей и органов. Белки защищают организмы от проникновения извне чужеродных веществ и болезнетворных микроорганизмов. Иммуноглобулины (или антитела) позвоночных животных – специализированные белки, способные распознать и обезвредить бактерии, вирусы, другие посторонние для организма структуры и вещества – антигены, воспринимаемые им как инородные. Они вызывают специфический иммунный ответ. Иммуноглобулинам присуща специфичность – определенное антитело образуется в ответ на поступление в организм того или иного антигена. Интерферон – это белок, который подавляет жизнедеятельность и размножение вирусов. Белки крови участвуют в процессах ее свертывания и образования тромбов, предотвращая кровопотери при повреждении стенок кровеносных сосудов. Защитную функцию могут выполнять некоторые ферменты, например лизоцим, который содержится в слюне, слизистых оболочках, слезной жидкости и обезвреживает различные болезнетворные агенты.
Подводя итоги вышесказанного, можно констатировать, что роль белков для живых организмов невозможно переоценить. Не случайно Энгельс определил жизнь как способ существования белковых тел.
IV. Ферменты –это биологические катализаторы.
Катализ – изменение скорости протекания химических реакций под действием определенных химических соединений. С участием фермента реакция осуществляется в 106–1012 раз быстрее, чем в среде без фермента. Чтобы в приемлемые сроки состоялась реакция без участия ферментов, нужны высокая концентрация реагирующих веществ в среде или повышенная температура, при которой ускоряется движение молекул и возрастает вероятность контактов молекул реагирующих соединений. Но в организмах концентрация веществ часто очень низкая, а высокие температуры для них опасны. Именно поэтому биохимические реакции не могут происходить без участия ферментов. Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества — продуктами.
Ферменты бывают простыми и сложными. Простые ферменты – это белковые молекулы, состоящие лишь из аминокислотных остатков (пепсин, трипсин и т. п.). Сложные ферменты, кроме белковой части, содержат еще и небелковую, которую называют кофактором. Кофакторами могут быть неорганические катионы или анионы. Органические кофакторы, прочно связанные с ферментом, называют также простетическими группами. Кофакторы органической природы, способные отделяться от фермента, называют коферментами. Белковый компонент определяет, какую именно реакцию катализирует данный сложный фермент. Активность сложных ферментов проявляется лишь тогда, когда их белковая и небелковая части соединены.
Каталитическая активность фермента определена не всей его молекулой, а лишь ее небольшим участком – активным центром. Его пространственная структура отвечает химическому строению субстрата. Именно поэтому действие фермента специфично. В одной молекуле фермента может быть несколько активных центров.
Ферменты образуют неустойчивые комплексы с субстратами. При контакте с ферментом субстрат, вступающее в реакцию, располагается в непосредственной близости к специфическим группам его активного центра. При этом уменьшается стабильность химических связей в молекуле субстрата. Известно, что для начала химической реакции необходима определенная энергия, названная энергией активации. Образовавшийся комплекс «фермент – субстрат» снижает энергию активации. Такой комплекс быстро распадается с образованием продуктов реакции. Сам фермент при этом не теряет своей активности и может катализировать следующую подобную реакцию.
Одни ферменты обеспечивают расщепление, другие – синтез определенных веществ. Например, фермент обеспечивает расщепление (гидролиз) целлюлозы, амилаза – гидролиз крахмала.
Активность фермента проявляется лишь в определенных условиях (температура, давление, рН и т. п.). Существуют также вещества, способные снижать активность ферментов – ингибиторы.
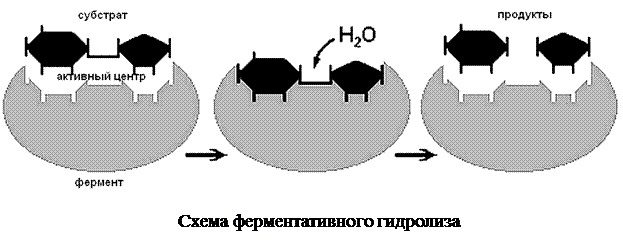 Ферментативные реакции происходят в виде ряда (до нескольких десятков) последовательных этапов, каждый из которых катализируется определенным ферментом. Цепи взаимосвязанных ферментативных реакций обеспечивают обмен веществ и превращение энергии в отдельных клетках и организме в целом.
Ферментативные реакции происходят в виде ряда (до нескольких десятков) последовательных этапов, каждый из которых катализируется определенным ферментом. Цепи взаимосвязанных ферментативных реакций обеспечивают обмен веществ и превращение энергии в отдельных клетках и организме в целом.
Литература:
Балан П.Г. Биология: Учебн. для общеобразоват. учебн. заведений: уровень стандарта, академический уровень / П.Г.Балан, Ю.Г.Верес,В.П.АПолищук; пер. с укр. – к,:Генеза, 2010. С. 41-58.
| <== предыдущая лекция | | | следующая лекция ==> |
| Техническая характеристика агрегата 2АНЩ | | | ТЕМА 4. ОРГАНИЧЕСКИЕ ВЕЩЕСТВА ЖИВЫХ ОРГАНИЗМОВ, ИХ РАЗНООБРАЗИЕ И БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ |
Дата добавления: 2014-12-15; просмотров: 1766;
