Первый закон термодинамики
Термодинамика рассматривает процессы, связанные с тепловыми явлениями. Процессы, протекающие в тепловых машинах, изучает техническая термодинамика; тепловые явления, сопровождающие химические реакции, - химическая термодинамика.
Химическая термодинамика построена главным образом на двух законах, которые не доказываются логическим путем. Они вытекают из обобщения многовекового человеческого опыта. Справедливость этих законов доказывается тем, что ни одно из следствий, к которым они приводят, не находится в противоречии с опытом.
Первый закон термодинамики связан с законом сохранения энергии, который устанавливает:
если в каком-нибудь процессе энергия одного вида исчезает, то вместо нее появляется энергия в другой форме, в количестве строго эквивалентном первому.
Любые переходы энергии соответствуют закону эквивалентности:
разные формы энергии переходят друг в друга всегда в одинаковых, строго эквивалентных соотношениях.
Отсюда следует, что в любой изолированной системе общий запас энергии сохраняется постоянным.
Формулировка первого закона термодинамики, вытекающая из постоянства запаса внутренней энергии изолированной системы:
В любом процессе приращение внутренней энергии DU=U2-U1 какой-нибудь системы равно количеству теплоты q,сообщенной системе, за вычетом совершенной системой работы А.
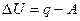 (1)
(1)
Для процессов, связанных бесконечно малыми изменениями:
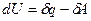 , (2)
, (2)
где dU- полный дифференциал внутренней энергии системы;
dq и dA- бесконечно малые количества теплоты и работы, зависящие от пути изменения состояния системы и от характеристики процесса. Теплота и работа характеризуют термодинамические процессы, а не состояние системы.
На основе первого закона термодинамики определяется термодинамическое понятие внутренней энергии системы:
внутренняя энергия - это величина, приращение которой в процессе равно сообщенной системе теплоте, сложенной с работой, совершенной над системой внешними по отношению к ней силами.
Внутренняя энергия системы зависит только от энергии начального U1 и конечного U2 состояний системы и не зависит от пути процесса. Поэтому внутренняя энергия системы является функцией состояния и однозначно определяется параметрами состояния системы (температурой, давлением, объемом), т.е. U=f (T, p, V).
Первый закон термодинамики может быть сформулирован следующим образом:
количество теплоты, полученное системой, равно увеличению ее внутренней энергии и произведенной ею работе
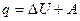 . (3)
. (3)
Так как металлургические процессы протекают при высоких температурах и низких давлениях, а в таких условиях реальные газы приближаются к идеальным, то при рассмотрении металлургических процессов можно без большой ошибки применять законы, которым подчиняются идеальные газы. На основании этого допущения получены следствия из первого закона термодинамики.
1. Рассмотрим изотерический процесс (Т=const.).
Внутренняя энергия идеального газа зависит только от температуры. В изотермическом процессе, когда Т=const., изменение внутренней энергии равно нулю DU=0, следовательно,
 . (4)
. (4)
В изотермическом процессе вся работа выполняется за счет подведенной к системе теплоты.
2. Изохорный процесс (V=const.).
В изохорном процессе работа не выполняется из-за неизменного объема системы. При V=const. А=0, следовательно,
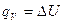 . (5)
. (5)
В изохорном процессе теплота расходуется только на приращение внутренней энергии системы.
3. Изобарный процесс (р=const.).
Работа изобарного расширения газа равна произведению давления на увеличение объема, т.е. 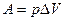 , тогда
, тогда
 . (6)
. (6)
При переходе из состояния 1 в состояние 2
 . (7)
. (7)
Выражение в скобках представляет собой термодинамическую функцию, которая называется энтальпия:
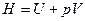 . (8)
. (8)
Энтальпия представляет собой сумму внутренней энергии системы и работы расширения или объемной энергии pV, переданной в окружающую среду. Энтальпия – функция состояния, т.е. 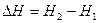 .
.
Следовательно, из уравнения (7) получаем
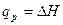 . (9)
. (9)
В изобарном процессе теплота увеличивает энтальпию системы.
При рассмотрении изохорных процессов (V=const.) удобнее пользоваться величиной изменения внутренней энергии ΔU; при рассмотрении изобарных процессов (р=const.) – величиной изменения энтальпии ΔН. Разница между ΔU и ΔН значительна для систем, содержащих вещества в газообразном состоянии, так как в этом случае объемная энергия pV имеет значительную величину. Для твердых и жидких тел, находящихся под атмосферным давлением, объемная энергия стремится к нулю pV→ 0 и энтальпия и внутренняя энергия практически одинаковы ΔН ≈ ΔU.
Следует отметить, что форма математической записи первого закона термодинамики (1) справедлива лишь при принятых условных обозначениях: в термодинамике и металлургических процессах принято считать все, что приходит в систему из внешней среды, положительным (+), а все, что уходит из системы, отрицательным (-).
В отличие от термодинамики в термохимии – разделе физической химии, посвященном экспериментальному изучению тепловых эффектов реакций, принята противоположная система знаков. В этой системе знаков положительными считаются убыль энергии и выделенная теплота. Чтобы отличить термохимическую систему знаков, используют буквенные обозначения величин с черточками сверху:  . Тогда математическое выражение первого закона термодинамики в системе знаков термохимии будет записано в следующем виде:
. Тогда математическое выражение первого закона термодинамики в системе знаков термохимии будет записано в следующем виде:
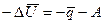 или
или 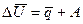 , (10)
, (10)
то есть убыль внутренней энергии системы является следствием выделения ею теплоты и совершения работы.
Дата добавления: 2014-12-05; просмотров: 1597;
