Химический состав природных вод
Вода в природных условиях всегда содержит растворённые соли, газы и органические вещества. Их количественный состав меняется в зависимости от происхождения воды и окружающих условий. При концентрации солей до 1 г/кг В. считают пресной, до 25 г/кг — солоноватой, свыше — солёной.
Наименее минерализованными водами являются атмосферные осадки (в среднем около 10—20 мг/кг), затем пресные озёра и реки (50—1000 мг/кг). Солёность океана колеблется около 35 г/кг; моря имеют меньшую минерализацию (Чёрное 17—22 г/кг; Балтийское 8—16 г/кг; Каспийское 11—13 г/кг). Минерализация подземных вод вблизи поверхности в условиях избыточного увлажнения составляет до 1 г/кг, в засушливых условиях до 100 г/кг, в глубинных артезианских водах минерализация колеблется в широких пределах. Максимальные концентрации солей наблюдаются в соляных озёрах (до 300 г/кг) и глубокозалегающих подземных водах (до 600 г/кг).
В пресных водах обычно преобладают ионы HCO3-, Са2+ и Mg2+. По мере увеличения общей минерализации растет концентрация ионов SO42-, Cl-, Na+ и К+. В высокоминерализованных водах преобладают ионы Cl- и Na+, реже Mg2+ и очень редко Ca2+. Прочие элементы содержатся в очень малых количествах, хотя почти все естественные элементы периодической системы найдены в природных водах.
Из растворённых газов в природных воде присутствуют азот, кислород, двуокись углерода, благородные газы, редко сероводород и углеводороды. Концентрация органических веществ невелика — в среднем в реках около 20 мг/л, в подземных водах ещё меньше, в океане около 4 мг/л. Исключение составляют воды болотные и нефтяных месторождений и воды, загрязнённые промышленными и бытовыми стоками, где количество их бывает выше. Качественный состав органических веществ чрезвычайно разнообразен и включает различные продукты жизнедеятельности организмов, населяющих воды, и соединения, образующиеся при распаде их остатков.
Первоисточниками солей природных воды являются вещества, образующиеся при химическом выветривании изверженных пород (Ca2+, Mg2+, Na+, К+ и др.), и вещества, выделявшиеся на протяжении всей истории Земли из её недр (CO2, SO2, HCI, NH3 и др.). От разнообразия состава этих веществ и условий, в которых происходило их взаимодействие с водой, зависит состав воды. Громадное значение для состава воды имеет и воздействие живых организмов.
Изотопный состав воды. В связи с существованием двух стабильных изотопов у Водорода (1H и 2H, обычно обозначаемые Н и D) и трёх у кислорода (16O,17O и 18O) известно 9 изотопных разновидностей воды, которые находятся в природной воде. Особый интерес представляет тяжёлая вода D2O, содержащая Дейтерий. В водах Земли находится всего13—20 кг «сверхтяжёлой» воды, содержащей радиоактивный изотоп водорода — тритий (3H, или Т).
Вода - слабый электролит, диссоциирующий по уравнению:
 (46)
(46)
Равновесие этой реакции сильно смещено влево.
Константу диссоциации воды можно вычислить по формуле:
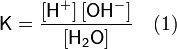 (47)
(47)
где:
- [H+] — концентрация ионов гидроксония (протонов);
- [OH−] — концентрация гидроксид-ионов;
- [H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 25 °C константа диссоциации воды равна 1,8·10−16моль/л. Уравнение (31) можно переписать как:
Кв = [Н+] [ОН-], где [Н+] и [ОН-] (48)
Обозначим произведение K·[H2O] = Kв = 1,8·10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25 °C).
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
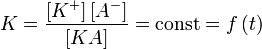 (49)
(49)
где:
- [KA] — концентрация недиссоциированного соединения в растворе;
- [K+] — концентрация катионов в растворе;
- [A−] — концентрация анионов в растворе.
Константу равновесия применительно к реакции диссоциации называют константой диссоциации.
Концентрация соответствующих ионов в г-ион/л; Кв составляет 10-14 (22°С) и 72·10-14 (100°С), что соответствует усилению диссоциации воды с ростом температуры.
Будучи электролитом, вода растворяет многие кислоты, основания, минеральные соли. Такие растворы проводят электрический ток благодаря диссоциации растворённых веществ с образованием гидратированных ионов. Многие вещества при растворении в воде вступают с ней в реакцию обменного разложения, называемую гидролизом. Из органических веществ в воде растворяются те, которые содержат полярные группы
(- ОН, - NH2, - СООН и др.) и имеют не слишком большую молекулярную массу. Сама вода хорошо растворима (или смешивается во всех отношениях) лишь в ограниченном числе органических растворителей. Однако в виде ничтожной примеси к органическим веществам воды присутствует практически всегда и способна резко изменять физические константы последних.
Вода любого природного водоёма содержит в растворённом состоянии различные вещества, преимущественно соли. Благодаря высокой растворяющей способности воды, получить её в чистом виде весьма трудно. Обычно мерой чистоты воды служит её электропроводность. Дистиллированная вода, полученная перегонкой обычной воды, и даже повторно перегнанный дистиллят имеют электропроводность примерно в 100 раз более высокую, чем у абсолютно чистой воды. Наиболее чистую воду получают синтезом из тщательно очищенного кислорода и водорода в специальной аппаратуре.
В обычных условиях вода - достаточно устойчивое соединение. Распад молекул H2O (термическая диссоциация) становится заметным лишь выше 1500°С. Разложение воды происходит также под действием ультрафиолетового (фотодиссоциация) или радиоактивного излучения. В последнем случае, кроме H2 и O2, образуется также перекись водорода и ряд свободных радикалов
Характерным химическим свойством воды является способность её вступать в реакции присоединения, а также гидролитические разложения взаимодействующих веществ. Восстановители действуют на воду преимущественно при высокой температуре. Только наиболее активные из них, как щелочные и щелочноземельные металлы, реагируют с водой уже при комнатной температуре с выделением водорода и образованием гидроокисей:
2Na + 2H2O = 2NaOH + Н2; Ca + 2H2O = Ca (OH)2 + H2. (50)
Магний и цинк взаимодействуют с водой при кипячении, алюминий - после удаления с его поверхности окисной плёнки. Менее активные металлы вступают в реакцию с водой при красном калении: 3Fe + 4H2O = Fe3O4 + 4H2. Медленное взаимодействие многих металлов и их сплавов с В. происходит при обычной температуре. Используя воду, содержащую изотоп кислорода 18O, удалось показать, что при коррозии железа во влажной атмосфере «ржавчина» получает кислород именно из воды, а не из воздуха. Благородные металлы — золото, серебро, платина, палладий, рутений, родий, а также ртуть с водой не взаимодействуют.
Атомарный кислород превращает воду в перекись водорода: H2O + O = H2O2.
Фтор уже при обычной температуре разлагает воду: F2+ H2O 2HF + О. Одновременно образуются также H2O2, озон, окись фтора F2O и молекулярный кислород O2.
Хлор при комнатной температуре даёт с водой хлористоводородную и хлорноватистую кислоты: Cl2 + H2O = HCl + HClO.
Бром и иод в этих условиях реагируют с водой аналогичным образом. При высоких температурах (100°С для хлора, 550°С для брома) взаимодействие идёт с выделением кислорода: 2Cl2 + 2H2O = 4HCl + O2.
Фосфор восстанавливает воду и образует метафосфорную кислоту (только в присутствии катализатора под давлением при высокой температуре): 2P + 6H2O = 2HPO3 + 5H2.
С азотом и водородом вода не взаимодействует, а с углеродом при высокой температуре даёт водяной газ: С + H2O = CO + H2. Эта реакция может служить для промышленного получения водорода, как и конверсия метана: CH4 + H2O = CO + 3H2 (1200—1400°С).
Вода взаимодействует со многими основными и кислотными окислами, образуя соответственно основания и кислоты. Присоединение воды к молекулам непредельных углеводородов лежит в основе промышленного способа получения спиртов , альдегидов, кетонов. Вода участвует во многих химических процессах как катализатор. Так, взаимодействие щелочных металлов или водорода с галогенами, многие окислительные реакции не идут в отсутствие хотя бы ничтожных количеств воды.
Среди химических веществ, обнаруживаемых в питьевых водах , могут встречаться также вещества, которые в небольших концентрациях изменяют органолептические свойства воды (запах, вкус, прозрачность и пр.). Наиболее часто органолептические свойства воды изменяют содержащиеся химические вещества, в природных водах (соли общей минерализации, железо, марганец, медь, цинк и др.), остаточные количества соединений, используемые как реагенты при обработке воды, а также промышленные загрязнения водоёмов.
Дата добавления: 2014-12-27; просмотров: 4056;
