Аэрозольное загрязнение атмосферы
Аэрозоли - это твердые или жидкие частицы, находящиеся во взвешенном состоянии в воздухе. Твердые компоненты аэрозолей в ряде случаев особенно опасны для организмов, а у людей вызывают специфические заболевания. В атмосфере аэрозольные загрязнения воспринимаются в виде дыма, тумана, мглы или дымки. Значительная часть аэрозолей образуется в атмосфере при взаимодействии твердых и жидких частиц между собой или с водяным паром. Средний размер аэрозольных частиц составляет 11-51мкм. В атмосферу Земли ежегодно поступает около 11 куб.км. 0пылевидныхчастиц искусственного происхождения. Большое количество пылевых частиц образуется также в ходе производственной деятельности людей.
Основными источниками искусственных аэрозольных загрязнений воздуха являются ТЭС, которые потребляют уголь высокой зольности, обогатительные фабрики, металлургические, цементные, магнезитовые и сажевые заводы. Аэрозольные частицы от этих источников отличаются большим разнообразием химического состава. Чаще всего в их составе обнаруживаются соединения кремния, кальция и углерода, реже - оксиды металлов: железа, магния, марганца, цинка, меди, никеля, свинца, сурьмы, висмута, селена, мышьяка, бериллия, кадмия, хрома, кобальта, молибдена, а также асбест. Еще большее разнообразие свойственно органической пыли включающей алифатические и ароматические углеводороды, соли кислот. Она образуется при сжигании остаточных нефтепродуктов, в процессе пиролиза на нефтеперерабатывающих, нефтехимических и других подобных предприятиях.
Постоянными источниками аэрозольного загрязнения являются промышленные отвалы - искусственные насыпи из переотложенного материала, преимущественно вскрышных пород, образуемых при добыче полезных ископаемых или же из отходов предприятий перерабатывающей промышленности, ТЭС.
Прозрачность атмосферы зависит главным образом от содержания в ней аэрозолей (пыль, дым, туман). Ухудшение прозрачности способствует созданию помех авиации, судоходству, нередко является причиной крупных транспортных аварий.
Пыль - один из наиболее распространенных загрязнителей атмосферы. Она оказывает вредное воздействие на живые организмы, растительный мир, ускоряет разрушение металлоконструкций, зданий, сооружений и имеет ряд других отрицательных последствий. Пыль включает в себя твердые аэрозоли, которые образуются в процессе выветривания земной породы, лесных пожаров, вулканических извержений, промышленных выбросов. Промышленная пыль - одна из основных составляющих. Ее содержание в воздухе определяется состоянием индустрии и транспорта. Уже сейчас во многих городах мира сложилась опасная ситуация, которая прямым образом воздействует на человека и его здоровье.
Взаимодействие аэрозолей с объектами техносферы. В зависимости от агрегатного состояния дисперсной фазы различают: туманы – аэрозоли с жидкой дисперсной фазой, дымы, пыли – аэрозоли с твердой дисперсной фазой; смоги – аэрозоли со смешанной дисперсной фазой.
Размеры частиц дисперсной фазы аэрозолей в соответствии с классификацией дисперсных систем колеблются в пределах от 10-7 до 10-9м. Но очень часто к аэрозолям относят и грубодисперсные системы с размерами частиц от 10-4 до 10-6 м.
Как и другие дисперсные системы, аэрозоли получают двумя методами: конденсационными и диспергационными. В конденсационном методе дисперсную фазу получают из парообразной путем физического процесса конденсации молекул до частиц коллоидного размера. Например, пар высокой концентрации охлаждается при разбавлении его холодным газом или при быстром расширении. Некоторые аэрозоли могут быть получены в результате химических реакций:
НСl (г) + NН3 (г) > NН4Сl (г) (40)
Н2О (г) + SО3 (г) > Н2SО4 (ж) (41)
Очень часто конденсационным методом получают аэрозоли в результате реакций горения (например, используемые в медицине «курительные сборы»).
Аэрозоли обладают способностью рассеивать свет. В них наблюдается конус Тиндаля. Из-за большей разницы в показателях преломления дисперсной фазы и дисперсионной среды интенсивность светорассеивания в аэрозолях больше, чем у лиозолей (лиозоль - дисперсная система, в которой твердые частицы с размером 10-5…10-7 см распределены в жидкой непрерывной среде). Этот факт используют для образования маскировочных дымовых завес.
Аэрозоли можно классифицировать по происхождению на две большие группы: естественные и антропогенные.
Аэрозоли естественного происхождения образуются в процессе вулканической деятельности, при сгорании метеоритов в верхних слоях атмосферы, в результате пылевых и песчаных бурь, лесных пожаров, разбрызгивания морской воды (морской аэрозоль), за счет жизнедеятельности растительного и животного мира.
Возникновение аэрозолей антропогенного происхождения обусловлено промышленной и хозяйственной деятельностью человека.
Аэрозольные частицы классифицируют также и по размеру частиц:
- частицы размером порядка 10-7 см называют частицами (или ядрами) Айткена. Такие частицы в значительной степени подвержены броуновскому движению. Частицы столь малых размеров очень быстро коагулируют с частицами больших размеров. Ядра Айткена формируют электрические поля в атмосфере;
- частицы размером порядка 10-6 см более стабильны, для них коагуляция при атмосферных условиях протекает достаточно медленно;
- частицы размером около 10-5 см называют «большими». На такие аэрозоли одинаково слабое воздействие оказывают как броуновское движение, так и гравитационное осаждение. Частицы таких размеров характеризуются наибольшим временем жизни в атмосфере;
- частицы размером около 10-4 см оседают под действием силы тяжести со средней скоростью 0,02 см/с, что составляет более 17 м в сутки. Скорость оседания частиц таких размеров возрастает пропорционально квадрату радиуса частицы;
- частицы размером порядка 10-3 см участвуют в образовании облаков; скорость оседания такой частицы при нормальных условиях составляет 2 см/с. Частицы таких размеров можно увидеть невооруженным глазом на контрастной поверхности;
- размер 10-2 см соответствует размеру капель измороси. Такие частицы оседают со скоростью 100 см/с. Частицы такого размера характерны также и для морских аэрозолей, но по причине высокой скорости оседания практически не наблюдаются далеко от источника образования. В хорошую погоду частицы таких размеров в атмосфере присутствуют крайне редко и в незначительных количествах;
- размер 10-1 см соответствует размеру дождевых капель. В атмосфере в год образуется приблизительно 4·1022 дождевых капель, что составляет 10 капель на 1 см2 поверхности Земли;
- жидких аэрозолей размером 1 см не наблюдается, поскольку крупные капли дождя из-за гидродинамических эффектов разбиваются до диаметра 0,5 см. Тем не менее, град и снежинки могут достигать таких размеров;
- 10 см - верхний предел размеров атмосферных частиц, хотя некоторые из них (например, частицы пепла при извержении вулканов) могут достигать и больших размеров.
Химический состав атмосферных аэрозолей достаточно разнообразен: они образуются органическими и неорганическими веществами, как гигроскопичными, так и нерастворимыми в воде. Большую часть аэрозольного вещества (70…80%) составляют нерастворимые в воде минеральные и органические соединения. Органические вещества в своем большинстве представляют собой продукты неполного сгорания углеводородного топлива. Их содержание оценивается в 20…25 мкг/м3, но существует и их естественный фон (3…6 мкг/м3) за счет веществ, выделяемых растениями. Некоторые химические элементы в атмосферных аэрозолях, такие как Si, Са, Аl, Fе, Мg могут иметь как естественное, так и антропогенное происхождение, в то время как РЬ, Мn, Zn и некоторые другие являются типичными продуктами производственной деятельности человека
2.10 "Кислотные дожди"
Термином "кислотные дожди" называют все виды метеорологических осадков - дождь, снег, град, туман, дождь со снегом, - рН которых меньше, чем среднее значение рН дождевой воды (средний рН для дождевой воды равняется 5.6). Выделяющиеся в процессе человеческой деятельности двуокись серы (SO2) и окислы азота (NОx) трансформируются в атмосфере земли в кислотообразующие частицы. Эти частицы вступают в реакцию с водой атмосферы, превращая ее в растворы кислот, которые и понижают рН дождевой воды. Впервые термин «кислотный дождь» был введен в 1872 году английским исследователем Ангусом Смитом. Кислотные дожди разрушают здания и памятники культуры, трубопроводы, приводят в негодность автомобили, понижают плодородие почв и могут приводить к просачиванию токсичных металлов в водоносные слои почвы.
Вода обычного дождя тоже представляет собой слабокислый раствор. Это происходит вследствие того, что природные вещества атмосферы, такие как двуокись углерода (СО2), вступают в реакцию с дождевой водой. При этом образуется слабая угольная кислота (CO2 + H2O —> H2CO3). Тогда как в идеале рН дождевой воды равняется 5.6 -5.7, в реальной жизни показатель кислотности (рН) дождевой воды в одной местности может отличаться от показателя кислотности дождевой воды в другой местности. Это, прежде всего, зависит от состава газов, содержащихся в атмосфере той или иной местности, таких как оксид серы и оксиды азота.
Механизм образования кислотных дождей. Когда электростанции и промышленные предприятия сжигают уголь и нефть, из их дымовых труб выбрасываются огромные количества диоксида серы, взвешенных частиц и оксидов азота. По мере того как выбросы диоксида серы и оксида азота из стационарных источников переносятся ветром на большие расстояния, из них образуются вторичные загрязнители, такие, как диоксид азота, пары азотной кислоты и капельки, содержащие растворы серной кислоты, сульфатных и нитратных солей. Эти химические вещества попадают на земную поверхность в виде кислотных дождей или снега, а также в виде газов, тумана, росы или твердых частиц. Эти газы могут непосредственно поглощаться листьями. Комбинация сухих и мокрых осаждений и поглощения кислот и кислотообразующих веществ вблизи земной поверхности или на ней называются кислотными осадками, или кислотными дождями (рис. 21).
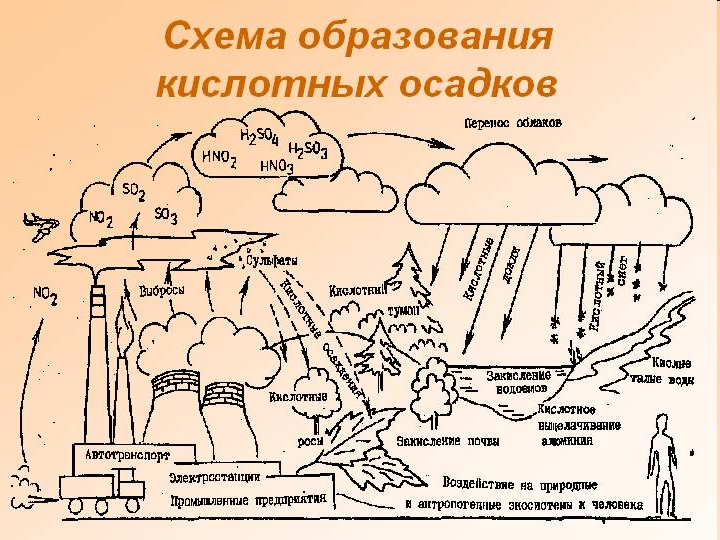
18 - Схема образования кислотных осадков
Еще одной причиной кислотных осадков являются выбросы оксида азота большим числом автомобилей в крупных городах. Такой вид загрязнения представляет опасность как для городских, так и для сельских районов. Так как капли воды и большинство твердых частиц довольно быстро удаляются из атмосферы, кислотные осадки являются скорее региональной или континентальной, чем глобальной проблемой.
Различные уровни кислотности и щелочности водных растворов обычно выражаются в единицах рН (рис. 4-7, с. 105, т. 2). В нейтральных растворах рН=7; в щелочных, или основных, рН > 7,а в кислых рН < 7. Чем меньше величина рН, тем более кислый раствор. Снижение рН на каждую единицу соответствует десятикратному возрастанию кислотности.
Кислотный дождь образуется в результате реакции между водой и такими загрязняющими веществами, как оксид серы (SO2) и различными оксидами азота (NOх). Эти вещества выбрасываются в атмосферу автомобильным транспортом, в результате деятельности металлургических предприятий и электростанций, а также при сжигании угля и древесины. Вступая в реакцию с водой атмосферы, они превращаются в растворы кислот - серной, сернистой, азотистой и азотной. Затем, вместе со снегом или дождем, они выпадают на землю.
Сухое и влажное осаждение кислот. В принципе имеются два альтернативных варианта подхода к проблеме кислотных дождей. Один из них базируется на утверждениях, что антропогенная деятельность является причиной выпадения кислотных дождей. Эта проблема возникла во второй половине XX в. и обусловлена главным образом чрезмерным выбросом в атмосферу окислов азота и сернистого газа. Кислотные дожди экологически опасны в силу их отрицательного влияния на любые экосистемы.
Второй вариант базируется на утверждениях, что исследования исторических данных не обнаруживают тенденций их изменения, что взаимосвязь между выбросами , а также NOх и степенью кислотности атмосферных осадков значительно слабее предполагаемой и что взаимосвязь между кислотными дождями и экологическим ущербом проявляется в значительно меньшей степени или даже почти отсутствует.
Рассмотрим первый вариант. Примем следующие четыре исходных положения:
- большие количества атмосферных загрязнений, выделяющихся за счет сгорания топлива, промышленного производства и широкого применения химикатов, определяют большие потоки первичных кислых примесей, которые могут вносить существенный вклад в кислотность атмосферы;
- среднее время существования загрязнений зависит от многих факторов, в частности от стабильности атмосферы, частоты выпадения осадков, присутствия индивидуальных компонентов атмосферы и т.д.;
- большинство загрязнений остается в пределах нижней части тропосферы и относительно равномерно распределено внутри перемешивающегося слоя;
- увеличение потоков кислотности к поверхности земли возникает за счет атмосферных осадков с повышенной кислотностью ("мокрое осаждение") и за счет адсорбции и выпадения в осадок газов и аэрозолей ("сухое осаждение").
Газовые выбросы от производственных процессов, широкомасштабное применение минеральных удобрений, пестицидов, растворителей, фреонов, использование ископаемых видов топлива для производства тепла и энергии, включая двигатель внутреннего сгорания, являются основными источниками загрязнения атмосферы. При этом и NOх считаются главными предшественниками кислотных дождей после превращения в серную и азотную кислоты. Надо сказать, что выяснение механизма окисления первичных загрязнений - , NOх, HCl - весьма сложная физико-химическая задача, хотя и представляет собой наиболее интересный аспект атмосферной кислотности. Достаточно указать на то, что процесс превращения диоксида серы в сульфат в атмосфере протекает различными путями и приводит к образованию различных продуктов окисления: и т.д.
Наконец, третий процесс связан с переносом сильных кислот и их солей к поверхности земли посредством сухого или мокрого осаждения.
Сухое осаждение - это прямой перенос с последующей адсорбцией газов и частиц природными поверхностями (растительностью, водой, почвой).
Мокрое осаждение - косвенный перенос некоторых частиц из атмосферы к поверхности земли с дождем, снегом или градом внутри или на поверхности частиц соответствующих видов осадков. Общая картина для кислых и основных компонентов, принимающих участие в химических равновесиях, реализуемых в каплях дождя, приведена на рис. 19 .
Переходя к рассмотрению результатов воздействия кислотных дождей на качество окружающей среды, необходимо, прежде всего, указать на многоплановость этого воздействия. Однако если даже ограничиться лишь несколькими конкретными примерами, то, очевидно, и этого будет достаточно, чтобы получить вполне определенное представление о характере воздействия. Одним из таких примеров может служить влияние кислотных дождей на содержание алюминия в почве.
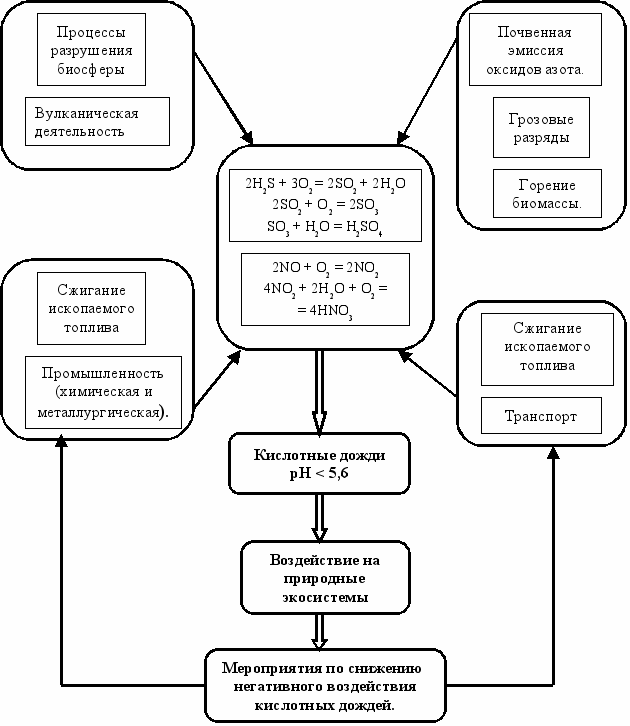
Рисунок 19 - Схема модели возникновения кислотных дождей в атмосфере
Многочисленные исследования указывают на значительный рост геохимической подвижности алюминия в почвах и водоемах, подвергшихся выпадению кислотных дождей. Результатом этого является неуклонное возрастание концентрации алюминия, которое совместно со снижением рН представляет серьезную опасность для рыбы и других форм аквафлоры.
Переходя к рассмотрению результатов воздействия кислотных дождей на качество окружающей среды, необходимо, прежде всего, указать на многоплановость этого воздействия. Однако если даже ограничиться лишь несколькими конкретными примерами, то, очевидно, и этого будет достаточно, чтобы получить вполне определенное представление о характере воздействия. Одним из таких примеров может служить влияние кислотных дождей на содержание алюминия в почве.
Многочисленные исследования указывают на значительный рост геохимической подвижности алюминия в почвах и водоемах, подвергшихся выпадению кислотных дождей. Результатом этого является неуклонное возрастание концентрации алюминия, которое совместно со снижением рН представляет серьезную опасность для рыбы и других форм аквафлоры.
Алюминий как один из распространенных элементов обычно связан в недоступной форме в фазе почвенных минералов. С помощью эксперимента по моделированию кислотного дождя можно доказать, что подкисление переводит Аl из твердой почвы в фазу раствора, причем увеличение геохимической подвижности зависит от количества и природы присутствующих в почве органических лигандов (например, гуминовых и фульвовых кислот).
Результаты эксперимента по моделированию кислотного дождя показывают, что подкисление может высвободить Аl из твердой почвенной фазы в фазу раствора (К>K'), и увеличение мобильности зависит от количества и природы органических лигандов в почве.
Лиганды (от лат. ligo - связываю), нейтральные молекулы, ионы или радикалы, связанные с центр. атомом комплексного соединения. Ими могут быть ионы (Н-, Наl-, NO3-, NCS- и др.), неорганические молекулы (Н2, Сn, N2, Рn, О2, Sn, СО, СО2, NH3, NO, SO2, NO2, COS и др.), органические соединения, содержащие элементы главных подгрупп V, VI, VII гр. периодической системы.
Как свидетельствуют результаты экспериментов и литературные данные, чем больше количество сильносвязывающих лигандов, тем больше увеличивается подвижность Аl. Такие лиганды распространены в верхних горизонтах больше, чем в нижних. В настоящее время неоспоримо доказано, что алюминий - это реальный токсический агент в озерной воде и подкисленных водосборных площадях, причем этот металл выщелачивается в больших количествах из почв при подкислении. Алюминийсодержащая буферная система может замещать обычную гидрокарбонатную буферную систему, когда озера подкислены, и при рН, близких к 5, максимальная токсичность алюминия приводит к высокой смертности рыб.
Кислотный дождь оказывает отрицательное воздействие на водоемы - озера, реки, заливы, пруды - повышая их кислотность до такого уровня, что в них погибает флора и фауна. Водяные растения лучше всего растут в воде со значениями рН между 7 и 9.2. С увеличением кислотности (показатели рН удаляются влево от точки отсчета 7) водяные растения начинают погибать, лишая других животных водоема пищи. При кислотности рН 6 погибают пресноводные креветки. Когда кислотность повышается до рН 5.5, погибают донные бактерии, которые разлагают органические вещества и листья, и органический мусор начинает скапливаться на дне. Затем гибнет планктон - крошечное животное, которое составляет основу пищевой цепи водоема и питается веществами, образующимися при разложении бактериями органических веществ. Когда кислотность достигает рН 4.5, погибает вся рыба, большинство лягушек и насекомых.
Кислотный дождь наносит вред не только водной флоре и фауне. Он также уничтожает растительность на суше. Ученые считают, что хотя до сегодняшнего дня механизм до конца еще не изучен, сложная смесь загрязняющих веществ, включающая кислотные осадки, озон, и тяжелые металлы в совокупности приводят к деградации лесов.
Имитационная модель возникновения кислотных дождей в атмосфере описывает различные источники выбросов соединений серы и азота в атмосферу, химические реакции, в результате которых в атмосфере образуются серная и азотная кислоты и влияние кислотных осадков на природные экосистемы и человека. Также рассматривается ряд мероприятий по снижению образования кислотных дождей в атмосфере. На входе модели рассматриваются различные источники поступления окислов серы и азоты. Эти источники могут иметь как природное, так и антропогенное происхождение. Вклад антропогенных источников в образование кислотных дождей во много раз превышает вклад природных источников. Поэтому необходимо применение мер по снижению именно антропогенных выбросов окислов серы и азота в атмосферу. Смотреть рисунок-схему ниже.
Показателем влияния кислотных дождей является подкисление воды. Имеется убедительное доказательство уменьшения величины рН пресной воды за последние десятилетия; причем подкисление, наблюдаемое на различных водных участках, хорошо согласуется с изменениями состава осадков. Замечено, что во множестве кислых рек и озер происходит интенсивный рост водорослей и мхов. Многие водоросли в процессе фотосинтеза неактивны. Накопление водорослей при низких значениях рН, вероятно, обусловлено меньшим разложением и уменьшением поедания беспозвоночными животными. Минерализация водных организмов в кислых растворах замедляется, что приводит к накоплению вещества на дне озер и увеличению скорости образования мхов. Плотные студенистые грибковые подстилки уменьшают количество кислорода, необходимого для аэробного разложения. В конечном счете уменьшается возврат в цикл фосфора, который имеет большое значение для продуктивности озер. Нельзя не отметить, что при всем этом имеет место также изменение донных беспозвоночных, составляющих пищу для рыб и весьма чувствительных индикаторов изменения рН. Так, при рН ниже 4,5 не обнаруживаются никакие ракообразные, улитки, мидии, и при этом не может жить никакая имеющая промысловое значение пресноводная рыба.
Наконец, показательным примером может служить влияние кислотных дождей на архитектурные сооружения и памятники. Обычные материалы для каменной кладки - это известняк, мрамор, песчаники, базальт, гранит. Кроме того, используются и искусственные материалы, такие, как кирпич, бетон, различные известковые растворы. Хорошо известно, что эти материалы в основном состоят из карбонатов и силикатов, все обладают высокой чувствительностью к воздействию кислых осаждений и к присутствию атмосферного. Так, например, если взять мрамор, то под действием указанных химических агентов протекают реакции. Основной реакцией, ответственной за разрушение мрамора и повреждения памятников, является образование сульфата, которое происходит на поверхности этих материалов. При этом окисление до происходит за счет каталитического действия таких поверхностных примесей, как , копоть, влага, а также благодаря окисляющим серу бактериям. Обобщение большой информации, в том числе и рассмотренной выше, позволяет сделать ряд далеко идущих выводов о влиянии кислотных дождей на окружающую среду. В частности, можно утверждать, что:
- кислотный дождь изменяет величину рН рек и озер и может вызвать их биологическую смерть;
- при поглощении почвами кислотный дождь выщелачивает основные природные минералы (калий, кальций, магний) и, унося их в подпочвенный слой, лишает деревья и растения питательных веществ;
- под влиянием кислотных дождей возрастает геохимическая подвижность алюминия, приводящая одновременно со снижением рН к возрастанию его концентраций и изменению его токсичных форм;
- кислотные дожди способствуют разрушению каменной кладки, а также архитектурных сооружений и памятников.
Как уже отмечалось, к проблеме кислотных дождей имеются два противоположных подхода. Переходя к рассмотрению варианта, альтернативного предыдущему, необходимо подчеркнуть, что, по утверждению некоторых американских ученых, этот вариант представляет новый взгляд на проблему кислотных дождей. В соответствии с ним общепринятое мнение о том, что причиной кислотного дождя, а следовательно и экологического ущерба, является повышенное содержание и NOx в газовых выбросах, основано на ограниченном отборе данных и не подкреплено доказательствами с привлечением более широких доступных сведений. Чтобы понять суть данного подхода, целесообразно проследить взаимосвязь между выбросами и кислотностью дождей в какой-либо части планеты. Когда все внимание сосредоточено на содержании выбросов и сульфатов в атмосферных осадках, то кажется возможным принять, что сульфат является основным признаком кислотности в атмосферных осадках и выразителем концентрации водородных ионов. Между тем в действительности для корректного определения кислотности дождя с помощью химических методов требуется учет по меньшей мере восьми видов ионов: трех анионов, активирующих кислоту (сульфата, нитрата, хлорида), и пяти катионов, нейтрализующих кислоту (калия, натрия, кальция, магния, аммония). Выраженная в микроэквивалентах на 1 л разность между суммами анионов и катионов определяется как концентрация водородных ионов или кислотность:
Озон в атмосфере. Озоновый слой планеты
Контроль за уровнями озона в тропосфере. Уровень озона в тропосфере зависит прежде всего от выбросов оксидов азота и углеводородов в сочетании с .солнечным светом (рис. ). Таким образом, снижение уровня озона требует комплексного применения методов контроля на входе и на выходе, уже обсуждавшихся применительно к оксидам азота и автотранспорту.
Это требует также уменьшения выбросов углеводородов. В 1989 г. Окружной совет по управлению качеством воздуха побережья Южной Калифорнии предложил радикальную программу уменьшения содержания озона и фотохимического смога в районе Лос-Анджелеса. Федеральным агентством охраны окружающей среды, потребуется:
- строгий контроль за переработкой нефти, сухой чисткой одежды, окраской автомобилей, типографиями, пекарнями, мусоросжигающими заводами и другими ^промышленными производствами, выбрасывающими большое количество углеводородов и других загрязнителей, или перемещение этих предприятий; должны быть запрещены типы шин, выделяющие твердые частицы;
- запрещение использования аэрозольных распылителей, красок, домашних очистителей, жидкостей для растопки шашлычных, а также других продуктов, служащих источником углеводородов, или нахождение им замены;
- постепенная замена бензиновых двигателей в течение двух десятилетий путем перевода к 1998 г. 40% легковых автомобилей и 70% грузовиков, автобусов и газонокосилок на альтернативные виды топлива — метанол, этанол, природный газ или электричество. Автобусный парк должен осуществить это к 1991 г., такси и прокат машин ~ к 1993 г.; к 2009 г. должны быть запрещены все виды машин и судов, работающих на бензине;
- использование систем переработки паров углеводородов на бензоколонках и продажа альтернативных видов топлива;
- повышение стоимости парковки, для сокращения использования автомобилей и поощрения маршрутных перевозок и общественного транспорта;
- запрещение 70% парка грузовиков выезжать на улицы в утренние и вечерние часы пик в рабочие дни.
Осуществление этого плана обойдется в 2,8—15 млрд. долларов в год, причем он может быть похоронен под влиянием общественного мнения, когда жители начнут ощущать неудобство от таких радикальных перемен. Однако сторонники этого плана доказывают, что альтернатива, состоящая в дальнейшем ухудшении качества воздуха в самом загрязненном городе страны, обойдется потребителям и предпринимателям намного дороже.
Истощение озона в стратосфере. В 1974 г. химики Шервуд Роланд и Марио Молина теоретически предположили, что хлорфторуглероды (ХФУ) — более известные как фреоны — понижают среднюю концентрацию озона в стратосфере. В 1930 г., когда были изобретены хлорфторуглероды, предположить об этом их свойстве никто не мог.
Устойчивые, без запаха, не воспламеняющиеся, не ядовитые, не вызывающие коррозию вещества были мечтой химиков. Скоро их стали широко использовать в качестве охладителей в кондиционерах воздуха и холодильниках, а также в аэрозольных баллончиках. ХФУ применяют для чистки электронных деталей, в качестве стерилизаторов в больницах, для изготовления пенополистирола и других пенопластов для изоляции и упаковки. После 1945 г. резко возросло использование четырех основных типов ХФУ. Широко использовались также соединения, содержащие бром, — халоны, главным образом в огнетушителях. На долю индустриальных стран приходится 84% всех производимых в мире хлорфторуглеродов, причем лидирующая роль принадлежит Соединенным Штатам, за которыми следуют Япония и западноевропейские страны.
С 1978 г. использование ХФУ в аэрозольных баллончиках запрещено в США, Канаде и в большинстве Скандинавских стран. Однако во всем мире резко возросло их использование в других целях, а в странах Западной Европы ив аэрозолях, на долю которых все еще приходится 25% глобального потребления ХФУ. Основным источником поступления ХФУ в атмосферу являются аэрозольные баллончики, выброшенные или протекающие холодильники и кондиционеры, а также сжигание пенопластов. В зависимости от типа ХФУ сохраняются в атмосфере от 22 до 111 лет.
| Рисунок 20 – Разрушение озона оксидами азота |
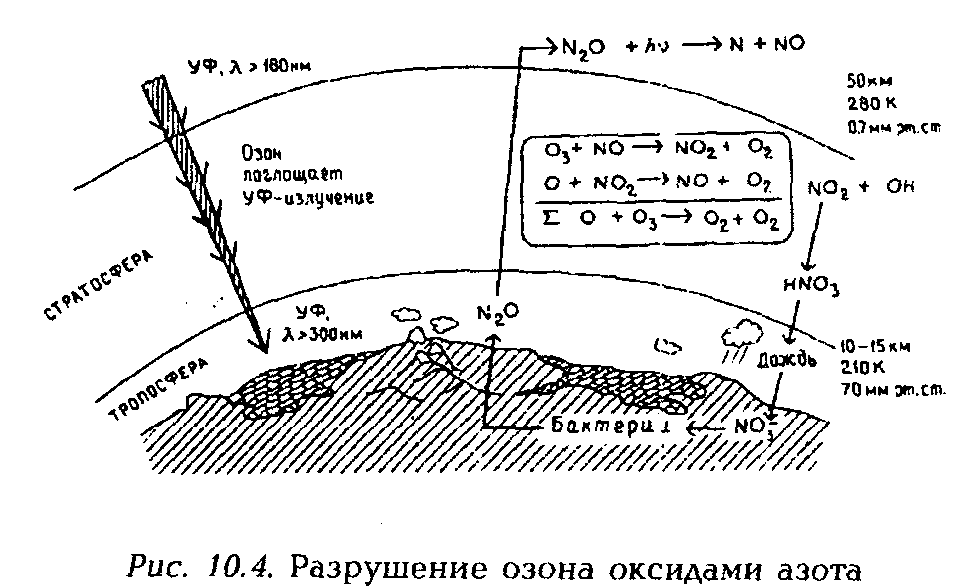
В течение нескольких десятилетий хлорфторуглероды постепенно перемещаются в стратосферу. Там под воздействием высокоэнергетической УФ-радиации они распадаются с высвобождением атомов хлора, что ускоряет превращение озона в кислород. Со временем один-единственный атом хлора может превратить до 100 тыс. молекул О3 в молекулы О2. Атомы брома, выделяемые в стратосфере из халонов, также превращают озон в кислород. ХФУ относятся к парниковым газам и вносят свой вклад в глобальное потепление.
В 1988 г. Национальное управление по аэронавтике и исследованию космического пространства (НАСА) опубликовало исследование, показавшее, что количество стратосферного озона над наиболее густонаселенными районами Северной Америки, Европы, Китая и Японии уменьшилось после 1969 г. на 3% . Над Скандинавией и Аляской среднее сокращение озона зимой составляет 6%.
В 1980-х годах ученые были потрясены, обнаружив, что ежегодно с сентября по ноябрь разрушается до 50% озона в верхней стратосфере над Антарктикой. В 1987г. эта озоновая дыра покрывала территорию, равную площади Соединенных Штатов. Исследования свидетельствуют, что ежегодное уменьшение количества озона над Южным полюсом вызвано присутствием ледяных облаков, которые активизируют разрушающие озон ХФУ. В 1989 г. присутствие хлорфторуглеродов было обнаружено и в стратосфере над Северным полюсом. Таким образом, в ближайшее время ежегодно в течение нескольких месяцев над Арктикой будет, по-видимому, наблюдаться еще одна озоновая дыра.
На озоновый слой в стратосфере могут оказать влияние сильные извержения вулканов и естественные климатические процессы, такие, как циклические изменения солнечной активности. Однако имеются убедительные и все крепнущие свидетельства того, что ХФУ, галогены и другие содержащие хлор вещества (такие, как тетрахлорид углерода и метиловый хлороформ, используемые как средства для очистки и удаления жиров) являются главной причиной истощения озонового слоя стратосферы.
Последствия истощения озона. Чем меньше будет озона в стратосфере, тем больше ультрафиолетовой радиации будет поступать на землю. Уменьшение количества стратосферного озона на 5% вызовет следующие последствия, например, для Соединенных Штатов:
- ежегодно дополнительно будет регистрироваться 940 тыс. случаев рака кожи в базальных и сквамозных клетках, обезображивающих, но не фатальных при своевременном лечении видов рака;
- ежегодно регистрируемые случаи, как правило, смертельного меланомного рака кожи, который в настоящее время убивает 9000 американцев/ в год, возрастут на 30 тыс.;
- резко участятся случаи катаракты глаз и сильных солнечных ожогов у людей, а также чаще будут отмечаться случаи рака глаз у скота;
- иммунная система человека будет нарушаться, что уменьшит сопротивляемость разнообразным инфекционным болезням;
- увеличится содержание крайне вредного озона в вызывающем раздражение глаз фотохимическом смоге и кислотных осадков в тропосфере;
- сократятся урожаи важных пищевых культур, таких, как кукуруза, рис, соя, пшеница;
- будет причинен ущерб некоторым видам водных растении, являющихся важными элементами пищевых цепей в океане;
- ежегодный ущерб от разрушения пластиков и других полимеров составит 2 млрд. долларов;
- произойдет глобальное потепление (парниковый эффект), которое приведет к изменению климата, продуктивности сельского хозяйства и лесов и повлияет на выживание диких животных.
Защита озонового слоя. Модели атмосферных процессов показывают, что для: поддержания количества ХФУ, в атмосфере на уровне 1987 г. необходимо немедленно снизить величину их выбросов во всем мире на 85%. Аналитики считают, что первым шагом на пути к этой цели должно быть незамедлительное глобальное запрещение использования ХФУ, которым уже имеются доступные по цене заменители, в аэрозольных распылителях и в производстве пенопластов. Следует также потребовать от станций обслуживания автомобилей вторично использовать ХФУ из автомобильных кондиционеров, а продажа небольших баллончиков, содержащих ХФУ, которые используются потребителями для подзарядки протекающих автомобильных кондиционеров, должна быть запрещена к 2002 г.
Следующим шагом должно бы быть запрещение любого использования хлорфторуглеродов, галогенов, метилового хлороформа и тетрахлорида углерода к 1995 г. Заменители охладителей в холодильниках и воздушных кондиционерах будут, по-видимому, более дорогими.
Однако даже если бы все хлорфторуглероды были запрещены завтра, планете потребуется около 100 лет, чтобы ликвидировать последствия современного истощения озона и, следовательно, обезопасить ХФУ и галогены, уже находящиеся в атмосфере. Ключевой вопрос заключается в том, могут ли развивающиеся страны согласиться пожертвовать кратковременной экономической выгодой, отказавшись от использования ХФУ и галогенов ради защиты жизни на Земле в предстоящие десятилетия.
Озоновый слой. Озоновый слойчасть стратосферы на высоте от 12 до 50 км (в тропических широтах 25—30 км, в умеренных 20—25, в полярных 15—20), в которой под воздействием ультрафиолетового излучения Солнца молекулярный кислород (О2) диссоциирует на атомы, которые затем соединяются с другими молекулами О2, образуя озон (О3). Относительно высокая концентрация озона (около 8 мл/м³) поглощает опасные ультрафиолетовые лучи и защищает всё живущее на суше от губительного излучения. Более того, если бы не озоновый слой, то жизнь не смогла бы вообще выбраться из океанов и высокоразвитые формы жизни типа млекопитающих, включая человека, не возникли бы. Наибольшая плотность озона встречается на высоте около 20—25 км, наибольшая часть в общем объёме — на высоте 40 км. Если бы можно было извлечь весь озон, находящийся в атмосфере, и сжать под нормальным давлением, то в результате вышел бы слой, покрывающий поверхность Земли толщиной всего 3 мм. Для сравнения, вся сжатая под нормальным давлением атмосфера составляла бы слой в 8 км.
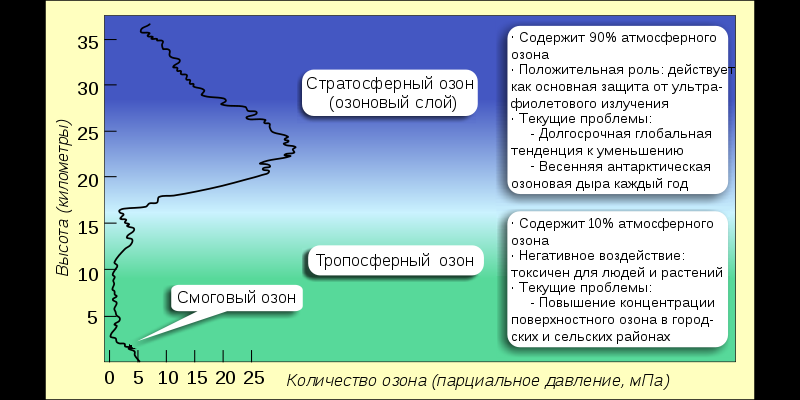
Рисунок 21 - Озоновый слой в атмосфере
Механизм образования, а также расходования озона был предложен Сидни Чепменом. Реакции образования озона:
О2 + hν → 2О. О2 + O → О3. (42)
Фотолиз молекулярного кислорода происходит в стратосфере под воздействием ультрафиолетового излучения с длиной волны 175—200 нм и до 242 нм.
Озон расходуется в реакциях фотолиза и взаимодействия с атомарным кислородом:
О3 + hν → О2 + О. О3 + O → 2О2.
Кроме реакций, входящих в механизм Чепмена, имеется целый ряд других реакций, приводящих к гибели озона. Их все объединяют в несколько семейств, главными из которых является азотное, кислородное (из механизма Чепмена), водородное и галогеновое. Эти реакции представляют собой каталитические циклы, поэтому их также называют соответствующими циклами.
Азотный цикл (NOx):
N2O + O(1D) → NO + NO, (43)
О3 + NO → NO2 + О2, (44)
NO2 + О → NO + О2. (45)
Глобальное потепление в результате парникового эффекта. Поступление одного или нескольких парниковых газов в атмосферу вызвало бы повышение средней температуры ее нижнего слоя в результате усилившегося парникового эффекта (рис. 5-5, с. 180, т. 1).. По-видимому, именно это и случилось главным образом из-за антропогенных эмиссий газов в атмосферу (рис. 4-14). За период с 1860 по 1988 г. средний уровень диоксида углерода в атмосфере Земли вырос на 25%, резкий скачок отмечался после 1958 г. (рис. 4-14а). На 80% такой подъем обусловлен сжиганием ископаемого топлива, причем 75% диоксида углерода поступает из развивающихся стран. Около 22% мировых выбросов диоксида углерода приходится на Соединенные Штаты, где доля сжигания ископаемого топлива в промышленности составляет 29%, на электростанциях — 28, на транспорте - 27, в жилых и служебных помещениях — 16%. Горящие леса также являются источником поступления в атмосферу СО2, в то время как леса в целом поглощают углекислый газ. В среднем за год на одного американца приходится 4,5 метрических тонны (5 тонн) эмиссий СО2, больше, чем где-либо в мире. Сведение лесов, особенно массовая рубка и выжигание тропических лесов, обусловило примерно 20% роста концентрации диоксида углерода.
Дата добавления: 2014-12-27; просмотров: 6114;
