Общие сведения о гидросфере
Гидросфера — водная оболочка Земли, включающая океаны, моря, озёра, водохранилища, реки, подземные воды, почвенную влагу, составляет около 1,4—1,5 млрд. км3, причём на долю В. суши приходится всего около 90 млн. км3. Из них подземные воды составляют 60, ледники 29, озёра 0,75, почвенная влага 0,075, реки 0,0012 млн. км3. В атмосфере вода находится в виде пара, тумана и облаков, капель дождя и кристаллов снега (всего около 13—15 тыс. км3). Около 10% поверхности суши постоянно занимают ледники. На севере и северо-востоке СССР, на Аляске и Севере Канады — общей площадью около 16 млн. км2 всегда сохраняется подпочвенный слой льда (всего около 0,5 млн. км3. В земной коре — литосфере содержится, по разным оценкам, от 1 до 1,3 млрд. км3 воды, что близко к содержанию её в гидросфере. В земной коре значительные количества воды находятся в связанном состоянии, входя в состав некоторых минералов и горных пород (гипс, гидратированные формы кремнезёма, гидросиликаты и др.). Огромные количества воды (13—15 млрд. км3) сосредоточены в более глубоких недрах мантии Земли. Выход воды, выделявшейся из мантии в процессе разогревания Земли на ранних стадиях её формирования, и дал, по современным воззрениям, начало гидросфере. Ежегодное поступление воды из мантии и магматических очагов составляет около 1 км3. Имеются данные о том, что, воды хотя бы частично, имеет «космическое» происхождение: протоны, пришедшие в верхнюю атмосферу от Солнца, захватив электроны, превращаются в атомы водорода, которые, соединяясь с атомами кислорода, дают H2O.
Вода окись водорода, H20, простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом (11,19% водорода и 88,81% кислорода по массе), молекулярная масса 18,0160; бесцветная жидкость без запаха и вкуса (в толстых слоях имеет голубоватый цвет).
Вода входит в состав всех живых организмов, причём в целом в них содержится лишь вдвое меньше воды, чем во всех реках Земли. В живых организмах количество воды, за исключением семян и спор, колеблется между 60 и 99,7% по массе. Все воды Земли постоянно взаимодействуют между собой, а также с атмосферой, литосферой и биосферой
Вода – аномальное вещество. Причем. аномальны практически все свойства этой самой распространенной на Земле жидкости. Аномальны ее теплоемкость, коэффициент теплового расширения, величина поверхностного натяжения, температуры кипения и замерзания, диэлектрическая постоянная и т.д. По этим параметрам вода резко отличается от всех других известных жидкостей. У подавляющего большинства веществ твердая фаза тяжелее жидкой, а лед легче воды и плавает на ее поверхности. Причина – ажурная кристаллическая структура льда.
Многие «странности» воды объясняются своеобразием строения ее молекулы – самой маленькой из трехатомных молекул. Радиус молекулы воды лишь ненамного превышает радиус иона кислорода. Угол, между линиями, соединяющими протоны с центром атома кислорода, равен 105о. Такая структура обуславливает крайне неравномерное распределение зарядов в молекуле воды. Молекула воды является своеобразным диполем, один конец которого несет положительный заряд, а другой заряжен отрицательно. Таким образом, многие особенности воды объясняются наличием водородных связей.
Оказывается, нагретая вода даже после охлаждения некоторое время остается в метастабильном (активированном) состоянии и обладает повышенной способностью растворять многие вещества, например, карбонаты. Свойства воды во многом предопределяют свойства растворов, утверждал Д.И. Менделеев.
В.И. Вернадский считал воду особым минералом и выделял 485 ее видов, при этом он отмечал, что общее количество ее видов превышает 1500.
Все воды он разделил на 3 подгруппы: твердую воду (льды), газообразную (надземные и подземные пары) и жидкую. Среди жидких вод им были выделены классы пересных, соленых и рассольных вод. По физико-геологическим параметрам и характеру водовместилищ им были выделены царства, под царства и семейства вод:
Царства: поверхностных, подземных и глубинных вод.
Семейства: озерных, болотных, пластовых и др. вод.
По газовому составу: кислородные, углекислые. метановые, азотные. сероводородные, водородные воды и т.д.
Таким образом, классификация В.И. Вернадского учитывает не только геохимические особенности вод, но и физико-географические, а также геологические условия их распространения.
Все природные воды тесно связаны между собой и находятся в постоянном движении. Даже самые глубокие подземные воды участвуют в общем круговороте. Вода – самая универсальная и самая важная среда миграции. Все природные воды содержат растворенные газы, ионы недиссоциированные молекулы и коллоидные частицы. Вода – «это кровь земной коры».
Так как морская (точнее, океаническая) вода составляет основную массу гидросферы, именно ее состав без особой ошибки может быть принят за средний состав этой оболочки. Плотность этой воды нормальной солености при 0оС составляет 1,028. В океанических водах, помимо главных элементов - кислорода и водорода, входящих в состав самой воды, содержатся в растворенном состоянии многие химические элементы. Причем общее содержание количество растворенных соединений (или солей) в морской воде - соленость морской воды принято выражать в граммах на килограмм морской воды или в частях на тысячу (о/оо) или промилях. В открытом океане соленость колеблется в среднем около 35о/оо, поднимаясь до 40 о/оо в Красном море и Персидском заливе.
В результате настойчивой работы ученых многих стран был накоплен обширный аналитический материал, характеризующий содержание в воде морей и океанов не только главных, но и рассеянных химических элементов. Наиболее обоснованные сведения о Кларках элементов в морской воде приведены в работах А.П. Лисицына и К.Н. Туркиана.
Приведем для примера общее количество некоторых растворимых форм химических элементов, содержащихся в морской воде (в млн. т):
Cl – 26 513 610 000, Na – 14 746 680 000, SO42- - 3 70 370 000, S – 1 216 300 000, HCO3- - Mg – 1 776 890 000, Ca – 558 960 000, K – 530 190 000, 195 910 000, Br – 92 201 000, Sr -11 097 000, B – 6 096 000, Si – 4 110 000,….Mo – 13 700, Zn – 6 850, Fe -4658, Al – 1370,…Au – 15,1.
Как видно из приведенных данных, основную массу растворенных соединений составляют хлориды распространенных щелочных (в первую очередь, натрия) и щелочноземельных элементов, меньше содержится сульфатов, еще меньше гидрокарбонатов. Среди рассеянных элементов отчетливо доминируют бром, стронций, бор и фтор, в значительном количестве присутствуют йод и барий. В то же время, железо и алюминий, играющие роль главных элементов в земной коре, в океане имеют концентрацию более низкую, чем молибден и цинк!
Химические элементы в гидросфере находятся в разнообразных формах. Среди них наиболее характерны простые и комплексные ионы, а также молекулы, находящиеся в состоянии сильно разбавленных растворов. Распространены ионы, сорбционно связанные с частицами коллоидных и субколлоидных размеров, присутствующими в составе морской воды в виде тонкой взвеси. Особую группу составляют элементы органических соединений.
Морская вода также содержит в растворенном состоянии и газы. Поскольку атмосфера и гидросфера находятся в контакте, должно существовать определенное соотношение между количеством газов в растворе и их парциальным давлением в атмосфере. Б. Мейсон приводит данные по концентрациям некоторых газов, растворенных в морской воде:
Кислород – 0 -9 мг/л, азот – 8,4-14,5 мг/л, углекислый газ – 34 – 56 мг/л, агон – 0,2-0,4 мг/л, гелий и неон – 1,7х10-4 мг/л, сероводород – 0 -22 мг/л.
Несмотря на то, что общее количество наземных вод незначительно по сравнению с общей массой гидросферы, геохимически они очень важны, поскольку принимают активное участие в большинстве процессов, протекающих в биосфере. Для понимания этих и других процессов, происходящих в зоне гипергенеза, необходимо знать состав этих вод, т.е их основные химические параметры. В первую очередь, это минерализация, ионный состав и окислительно-восстановительные условия вод.
Минерализация отражает общее количество растворённых минеральных веществ. А.И. Перельманом выделяются следующие семейства:
- Ультрапресные воды (< 0,1 г/л). Большая часть атмосферных осадков, поверхностные и грунтовые воды тундровых, высокогорных ландшафтов. Обладают повышенной растворяющей способностью (интенсивный кариес – очень характерен для тех, кто долгое время работал в Арктике или в высокогорье).
- Пресные воды (0,1-1 г/л). Характерны для большинства рек, озёр и грунтовых вод во влажном климате.
- Солоноватые воды (1-3 г/л). развиты в степях, саваннах, пустынях. Растворяющая способность ослаблена, из них при небольшом повышении концентрации осаждаются труднорастворимые соли, что вызывает карбонатизацию и огипсование почв.
- Солёные воды (3-36 г/л). Океаны, слабо солёные озёра, часть грунтовых вод.
- Рассолы (> 36 г/л). Солёные озёра и грунтовые воды наиболее засушливых ландшафтов. Осаждение широкого химического набора солей.
Ионный состав вод. Ведущее значение для классификации имеют только ионы элементов с высокими кларками (O, Ca, Mg, Na, K, S, Cl и др.). Наиболее распространены в ландшафтах три катиона (Ca2+, Mg2+, Na+) и три аниона (HCO3-, SO42-, Cl-). Иногда ведущее значение приобретают CO32-, HS-, S2-. Также велико значение содержаний ионов Н+ и ОН-, но это уже касается выделения классов вод по кислотности – щёлочности.
Ионный состав вод определяет их многие геохимические свойства, а также возможности использования в хозяйственной деятельности.
Виды вод по анионному составу:
- гидрокарбонатные (НСО3) - предназначены для тех, кто занимается спортом (оказывают благоприятное влияние при усиленной мышечной работе, восстанавливая резервную щелочность крови, а также при диабете, инфекционных заболеваниях). Применяются при лечении мочекаменной болезни и подагры;
- сульфатные (SО4);
- натриевыми (Na);
- кальциевыми (Са);
- магниевыми (Mg) - помогают при стрессовых ситуациях;
- хлоридные (Cl) - способствуют регулировке работы кишечника, желчевыводящих путей и печени.
По наличию специфических компонентов минеральные воды делят на углекислые, сульфидные (сероводородные), азотные, кремнистые, бромистые, йодистые, железистые, мышьяковистые, радиоактивные (радоновые) и др.
Приняты следующие показатели содержания специфических компонентов, позволяющие относить водные источники к минеральным (лечебным).
Различают минеральные воды холодные — до 20°, теплые — 20—35°, горячие (термальные) — 35—42°, очень горячие (высокотермальные) — выше 42°.
Классификация питьевых минеральных вод. В зависимости от общей минерализации минеральные воды классифицируются на:
- пресные (минерализация до 1 г на дм³ включительно);
- слабоминерализованные (минерализация более 1 до 2 г на дм³ включительно);
- маломинерализованные (минерализация более 2 до 5 г на дм³ включительно);
- среднеминерализованные (более 5 до 10 г на дм³ включительно);
- высокоминерализованные (более 10 до 15 г на дм³ включительно).
В зависимости от назначения питьевые минеральные воды классифицируют на:
- столовые — минеральные воды с минерализацией менее 1 дм³ и с содержанием биологически активных компонентов менее установленной концентрации; столовые воды пригодны для ежедневного применения здоровыми людьми без ограничений;
- лечебно-столовые — минеральные воды с минерализацией более 1 и до 10 дм³ включительно при концентрации биологически активных компонентов менее установленных норм[4] или минеральные воды с минерализацией менее 1 дм³, но при превышении некоторыми биологически активными компонентами установленных норм; лечебно-столовые воды допускаются для столового потребления здоровыми людьми без ограничений непродолжительный период или нерегулярно; лечебно-столовые воды могут применяться для профилактики и лечения определённых заболеваний;
- лечебные — минеральные воды с минерализацией более 10 дм³ или с меньшей минерализацией, но при превышении концентрации некоторых биологически активных компонентов установленных норм; лечебные минеральные воды назначаются для лечебно-профилактического приёма при ряде заболеваний[5] и не рекомендованы для обычного столового питья.
В зависимости от газового состава и наличия специфических компонентов минеральные воды делят на: углекислые, сульфидные (сероводородные), азотные, кремнистые (H2SiO3), бромистые, йодистые, железистые, мышьяковистые, радиоактивные (Rn) и др.
Реакция воды (степень кислотности или щелочности, выражаемая величиной pH) имеет важное значение для оценки её лечебного действия. Кислые воды имеют pH = 3,5—6,8, нейтральные — 6,8—7,2, щелочные — 7,2—8,5 и выше.
Дальнейшее подразделение природных вод производится по катионному составу и соотношениям ионов.
Щелочно-кислотные условия вод.Характеризуются величиной pH – отрицательным логарифмом концентрации водородных ионов. От изменения этого параметра существенно зависит растворимость различных соединений. Так, осаждение из растворов гидроксидов металлов зависит, главным образом, от соотношения двух параметров: величины pH и концентрации ионов металлов в растворе.
Классы вод по щелочности-кислотности:
Сильнокислые (pH < 3-4). Распространены, как правило, на небольших площадях. Возникновение обычно связано с окислением сульфидов, проявлениями вулканической деятельности. Широко распространены в техногенных ландшафтах.
Слабокислые (рН – от 3-4 до 6,5). Кислотность обусловлена разложением органических веществ. Широко распространены в гумидных ландшафтах.
Нейтральные и слабощелочные (рН от 6,5 до 8,5). Характерны для аридных ландшафтов, в условиях более высокой концентрации карбонатных ионов.
Сильнощелочные (рН > 8,5) – содовые воды. Высокая щёлочность обусловлена присутствием NaHCO3.
Органические соединения обладают способностью усреднять сильнокислую и сильнощелочную среду. Слабые органические кислоты нейтрализуют щёлочи и делают щелочную реакцию более слабой, а слабые органические основания таким же образом нейтрализуют сильные кислоты.
Иизвестно, что минерализацию, ионный состав и рН природных вод удобнее всего выражать с помощью формулы Курлова.
Окислительно-восстановительные условия вод. Окисление – отдача электронов, восстановление – их присоединение.
Важнейший окислитель в ландшафтных средах – кислород, что обусловлено его высоким кларком и химической активностью. Важные окислители – SO42-, CO2, NO3-, Fe3+ и др. Важнейшие восстановители – H2, H2S, CH4 и другие органические соединения, Fe2+ и др. Один и тот же элемент, в зависимости от ионной формы его нахождения, может быть либо окислителем, либо восстановителем (Fe, Mn…).
Так как в любых химических процессах окисление всегда сопряжено с восстановлением и наоборот, об окислительных или восстановительных реакциях говорят применительно к конкретным ионам или группам ионов. (Окисление в виде реакции с кислородом сопровождается восстановлением кислорода, а восстановление сульфатов или соединений трёхвалентного железа при взаимодействии с органическими соединениями – окислением этих органических соединений).
Любая среда, в которой протекают окислительно-восстановительные реакции, может характеризоваться уровнем окисленности (или восстановленности). Количественный показатель – окислительно-восстановительный потенциал (Eh). Он существенно влияет на характер миграции многих химических элементов, нередко являясь определяющим параметром. Пример: активная миграция Fe2+ в северных болотах в условиях низкого Eh. Воды засушливых степей и пустынь с высоким Eh неблагоприятны для миграции Fe, так как в этих условиях железо находится в трёхвалентной форме, образуя труднорастворимые соединения.
Классы вод по окислительно-восстановительным условиям:
Кислородные воды. Характерно присутствие свободного кислорода, поступающего из воздуха или за счёт фотосинтеза водных растений. Eh выше +0,15 В, часто выше 0,4 В. железо обычно в трёхвалентной форме. Воды с высокой окислительной способностью, в них действуют аэробные бактерии, окисляющие органические вещества.
Глеевые воды. Восстановительные без сероводорода. Формируются там, где мало свободного кислорода и много органических остатков. Органические вещества окисляются анаэробными бактериями за счёт кислорода неорганических соединений. Fe, Mn – двухвалентны, имеют высокую подвижность. Eh всегда ниже 0Б4 В, часто ниже 0.
Сероводородные воды. Содержат H2S, HS-. Возникают в бескислородных условиях при высоких содержаниях SO42-, где анаэробные бактерии окисляют органические вещества за счёт восстановления сульфатов. Характерны для солончаков, илов солёных озёр, глубоких подземных вод в некоторых районах, для побережий, подпитываемых морскими водами (мангры). Условия для осаждения металлов. Fe и многие другие металлы не мигрируют, так как образуют труднорастворимые сульфиды. Eh обычно ниже 0, до -0,5 В.
Распределение этих классов в ландшафтах по вертикали не одинаково. Кислородные воды преобладают выше кислородной поверхности, ниже неё господствуют восстановительные условия.
Классификация вод по параметрам щелочности – кислотности и окислительно-восстановительным условиям может быть совмещена и изображена в табличной форме. В итоге выделяется 12 классов вод.
Поле изменчивости параметров рН и Еh можно представить в виде бинарной диаграммы, на которой области устойчивости различных соединений (pH-Eh диаграммы). Анализ таких диаграмм позволяет выделить естественные и запрещённые ассоциации химических соединений в природных ландшафтах.
Мировой океан – ключевое звено в биосфере. Его значение определяется несколькими факторами:
- ролью в энергетическом балансе (воды Мирового океана – аккумулятор тепловой энергии; избыток солнечной радиации расходуется на испарение океанических вод);
- ролью в круговороте воды (океан как накопитель вод и начальное звено в экзогенном круговороте воды);
- ролью океана как двустороннего фильтра (с одной стороны – осаждающего основной объём загрязнителей, поступающих с суши; с другой – растворяющего и осаждающего излишки вулканических и атмосферных газов).
Кроме того, океан – колыбель жизни на нашей планете. Именно с океана началось формирование биосферы Земли, и сейчас здесь развиты многочисленные сообщества живых организмов с огромной биомассой и высоким видовым разнообразием.
Именно с Мирового океана началось формирование биосферы. Здесь зародилась жизнь в известных нам формах, здесь же она развивалась на протяжении более трёх миллиардов лет – и лишь потом живые организмы стали осваивать иные обстановки в пределах географической оболочки нашей планеты. Уже этого достаточно, чтобы считать, что океан сыграл исключительно важную роль в формировании на Земле биосферы.
Но основную роль в циркуляции воды на Земле играет атмосферная влага – водяной пар и взвешенные частицы. Поступает вода в атмосферу в результате испарения под действием солнечной радиации. При этом, чем больший поток солнечной радиации достигает поверхности океана, тем большая доля энергии тратится на испарение (по отношению к нагреванию водной поверхности). Это очень важный механизм, способный существенно сглаживать температурные колебания и обеспечивать высокую степень стабильности температурного режима в ГО. Возможно, именно благодаря наличию Мирового океана с его терморегулирующей ролью значения температур в географической оболочке Земли за всю её геологическую историю никогда не выходили за рамки диапазона, в котором могут существовать известные нам формы жизни.
Водяной пар поднимается в более высокие слои атмосферы, а потоки воздушных масс разносят его по всей поверхности планеты. Охлаждаясь в атмосфере, водяной пар конденсируется и выпадает на поверхность в виде атмосферных осадков. Большая часть их (около 77%) выпадает над поверхностью океана. Так что основная доля круговорота воды замыкается в рамках системы гидросфера-атмосфера. Остальная часть поступает на поверхность суши, откуда, в конечном счёте, большей частью стекает обратно в океан.
Поэтому, если бы механизм испарения с поверхности океана и атмосферного переноса не действовал, поверхность суши оказалась бы безводной. Роль его в природных процессах очень велика. Поступление вод на сушу активизирует процессы выветривания (физическое дополняется химическим, которое в отсутствие воды проявлялось бы в весьма незначительных масштабах). Оно же обеспечивает водную транспортировку – главный механизм переноса вещества в экзогенном геологическом круговороте. В воде растворяются и газы, и минеральные вещества – и они же выделяются из растворов обратно, в другие оболочки. При этом те или иные вещества могут поглощаться водной средой из одной оболочки, а отдаваться в другую (осаждение первично атмосферного углерода в составе карбонатных отложений; выделение в атмосферу сероводорода, образованного за счёт растворённых сульфатных солей). Таким образом, с точки зрения обмена веществом именно круговорот воды связывает между собой все первичные компоненты биосферы.
Глобальный круговорот воды – основа системного единства всей географической оболочки, связи материков и мирового океана. Местные круговороты воды осуществляются в пределах ландшафтов и ландшафтно-геохимических систем, также связывая их в единое целое.
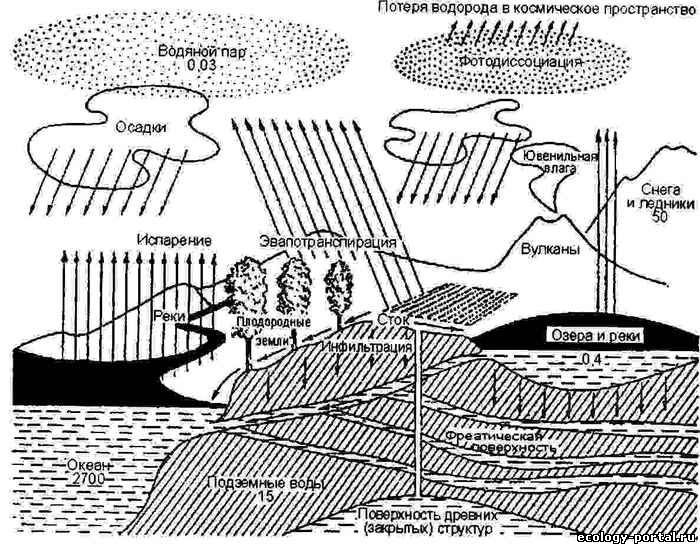
Рисунок 22 – Схема глобального круговорота воды
Часть воды всё время выходит из географического круговорота, связываясь с минеральным веществом в реакциях химического выветривания. Но, в конечном счёте, она всё равно возвращается в гидросферу, когда минералы снова теряют связанную в них воду в глубинных процессах (более широкий, геологический круговорот воды).
Дата добавления: 2014-12-27; просмотров: 5754;
