Изотопы водорода
| Изотоп | Заряд ядра (порядковый номер) | Число электронов | Атомная масса | Число нейтронов N=A-Z |
| Протий 11Н | ||||
| Дейтерий 21Н или 21Д | 2-1=1 | |||
| Тритий 31Н или 31Т | 3-1=2 |
Атомная масса элемента, указанная в периодической системе, определяется как средняя величина из масс всех его изотопов, взятых в процентном отношении, отвечающем их распространенности в природе. Поэтому атомные массы имеют дробные значения. Атомы разных элементов, имеющие разный заряд ядра, но одинаковую атомную массу, называются изобарами. Например, атом 4018Ar и 4019K являются изобарами, атомы 3918Ar и 3919K также являются изобарами.
Электроны в атоме располагаются по электронным слоям, или энергетическим уровнями. Максимальное число электронов на данном энергетическом уровне определяется формулой N=2n2, где n-номер уровня (считая от ядра).
Согласно этой формуле, в первом электронном слое может разместиться не более 2 электронов, во втором – не более 8, в третьем – не более 18, в четвертом – не более 32 и т.д.
| n=1 | N=2n2=2 |
| n=2 | N=2n2=8 |
| n=3 | N=2n2=18 |
| n=4 | N=2n2=32 |
(Более детальное заполнение электронных слоев 2, 8, 18-ю и т.д. электронами рассматривается на основе квантовых чисел.)
Заряд ядра атома (порядковый номер элемента в периодической системе элементов) определяет общее число электронов в атоме и, как следствие его, число внешних электронов. Например, элемент №9 – фтор, имеет 9 электронов, которые распределяются в соответствии с законами построения электронных оболочек следующим образом: 2, 7.
Элемент №10, неон, имеет 10 электронов, закономерно распределяющихся по слоям: 2, 8. У элемента №11, натрия, распределение электронов соответственно 2, 8, 1. Все три элемента имеют различное строение внешнего электронного слоя.
Электроны внешних слоев называются валентными и определяют химические свойства атома. При этом все химические элементы можно разделить на три основные группы. Элементы, атомы которых имеют 1-3 внешних электрона, являются металлами и легко отдают эти электроны при химических реакциях. Элементы, атомы которых имеют 4-7 внешних электронов, относятся к неметаллам и склонны принимать электроны от других атомов до завершения внешнего электронного слоя (до устойчивого октета). Атомы, имеющие завершенный внешний электронный слой (2 или 8 электронов), не склонны вступать в химические реакции и являются химически инертными.
В приведенном примере (9F, 10N, 11Na) даже небольшое изменение величины заряда ядра приводит к значительному изменению в химических свойствах элементов, что еще раз подчеркивает фундаментальное значение такой характеристики атома, как заряд ядра.
Современная формулировка периодического закона гласит:свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от зарядов их ядер (порядковых номеров элементов в периодической системе).
Периодическая система содержит 7 периодов (3 малых и 4 больших) и 8 групп, что соответствует максимальному числу электронов во внешних подоболочках. Группы делятся на главные (основные) и побочные подгруппы.
Подгруппой называется вертикальный ряд элементов, имеющих сходное строение внешнего электронного слоя и близкие химические свойства. Главные подгруппы содержат элементы малых и больших периодов. Побочные подгруппы содержат элементы только больших периодов.
Группа объединяет элементы, имеющие одинаковую высшую валентность (валентность по кислороду). Высшая валентность равна номеру группы (исключения: O, F; Cu, Ag, Au; Fe, Co, Ni и некоторые другие элементы). Подгруппы включают в себя элементы с аналогичными электронными структурами (элементы - аналоги). К главным подгруппам (подгруппам А) относятся подгруппы элементов второго периода: Li, Be, B, C, N, O, F и подгруппа благородных газов. К побочным подгруппам (подгруппам В) принадлежат d- и f- элементы. Первые шесть d- элементов от (Se до Fe) начинают соответствующие подгруппы от подгруппы III (Se) до подгруппы VIII (Fe). В подгруппу VIII также включаются все элементы семейства железа (Fe, Co, Ni) и их аналоги – платиновые металлы. Медь и ее аналоги, имеющие во внешней s- подоболочке по одному электрону, образуют первую побочную подгруппу. Лантоноиды и актиноиды (f- элементы) находятся в III подгруппе в соответствие с особенностями их электронных конфигураций.
Периодом называется горизонтальный ряд элементов, начинающийся щелочным металлом и заканчивающийся инертным газом. Исключение из этого правила представляет самый короткий I период, начинающийся водородом. Период это последовательный ряд элементов, размещенных в порядке возрастания заряда ядра атомов, электронная конфигурация которых изменяется от ns1 до ns2 np6 (или до ns2 у первого периода). Периоды начинаются с s- элемента и заканчиваются p- элементом (у первого периода s- элементом). Малые периоды содержат 2 и 8 элементов, большие периоды – 18 и 32 элемента, седьмой период остается незавершенным.
В периодической системе строго соблюдается ряд закономерностей, связанных со строением электронных оболочек атомов. Эти закономерности таковы:
-Число электронных слоев в атоме элемента равно номеру периода, в котором данный элемент находится. Например, у атома H и He всего один электронный слой, у атома C – два электронных слоя, у атома Cl – три, у атома Fr – семь и т.д.
-Для элементов главных подгрупп число электронов во внешнем электронном слое атома равно номеру группы, в которой находится данный элемент. Например, атом натрия находится в I группе и имеет 1 электрон в наружном слое, атом кремния находится в IV группе и имеет 4 электрона в наружном слое, атомы инертных газов расположены в VIII группе и имеют 8 внешних электронов.
Электроны (1-7) незавершенного внешнего слоя участвуют в образовании химических связей и являются валентными.
В побочных подгруппах распределение валентных электронов более сложное, чем в главных подгруппах. Общее число подвижных валентных электронов также равно номеру группы, но только 2 (реже 1) из них находятся во внешнем слое, а остальные помещаются в предпоследний слой. Например, в атоме марганца (элемент 7-й группы периодической системы) электроны распределены следующим образом:
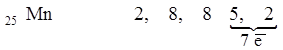
-В периодической системе сверху вниз по группе увеличивается металлическая активность элементов, т.е. способность отдавать электроны (поскольку с ростом порядкового номера растет число электронных слоев и ослабевает связь внешних электронов с ядром).
-В периодической системе слева направо по периоду увеличивается неметаллическая активность, т.е. способность принимать электроны (поскольку с ростом порядкового номера увеличивается число электронов во внешнем электронном слое, отдавать их становится все труднее, более выгодной будет тенденция дополнить внешний слой до устойчивой восьми электронной оболочки).В соответствии с вышеприведенными закономерностями самым активным металлом является франций, самым активным неметаллом является фтор. Вблизи диагонали, разделяющей эти два полюса, расположены элементы переходного и амфотерного характера: бор, алюминий, германий, мышьяк, теллур, астат и др. Необходимо уметь свободно ориентироваться в закономерностях периодической системы; по месту нахождения элемента в таблице рассказать о его свойствах, характерных валентных состояниях, важнейших соединениях.
3.2. Периодическая система элементов Д.И. Менделеева и электронная структура атомов.Рассмотрим связь между положением элемента в периодической системе и электронным строением его атомов. У каждого последующего элемента периодической системы на один электрон больше, чем у предыдущего. Полные записи электронных конфигураций первых двух периодов приведены в таблице 8.
Первый период состоит из двух элементов: водорода и гелия. Атомом гелия заканчивается формированием К - оболочки атома, обозначим ее [Не]. Электрон, который последним заполняет орбитали атома, называется формирующим, и элемент относится к группе, называемой по формирующему электрону. В данном случае оба элемента имеют формирующие s-электроны и соответственно называются s – элементами.
Таблица 8.
Дата добавления: 2014-12-26; просмотров: 3024;
