Курсовая работа в неорганической химии
Выполнение и написание курсовой работы является завершающим этапом общего практикума по неорганической химии для всех студентов химического факультета КазГУ им. Аль-Фараби.
Курсовая работа - это первый шаг к научной работе. Курсовая работа выполняется как правило под руководством преподавателя, ведущего практические занятия в данной академической группе. Ее можно также проводить в научных лабораториях кафедры под руководством аспирантов и научных сотрудников .
Тема курсовой работы может быть предложена научным руководителем, но она может быть выбрана самим студентом. Темой курсовой работы традиционно является синтез одного или нескольких соединений, их идентификация и исследования физических и химических свойств доступными студенту методами.
Основными разделами курсовой работы является:
1. Введение
2. Обзор литературы.
3. Экспериментальная часть
4. Выводы
5. Литература
Во введении излагается цель настоящего исследования и области применения синтезируемого соединения.
Любая научная работа начинается с изучения литературы по теме исследования. Курсовую работу также следует начинать с поиска сведений о физических и химических свойствах синтезируемого соединения, имеющиеся в мировой литературе. Методика поиска литературных данных подробно изложено в работах [1- 2]. Из просматриваемой справочной литературы следует выбирать только те данные, касающиеся только данного соединения, которые необходимы для обоснования выбора методов исследования или для обсуждения результатов исследования. Ссылки в тексте на цитируемую литературу даются в квадратных скобках и в том порядке, в каком упоминаются в тексте в соответствии с действующими стандартами [3 ].Вначале называют фамилию и инициалы автора, затем полное название статьи, после чего сокращенное (в соответствии с стандартами) название журнала, затем указываются год, том, выпуск, номер, страницы от и до. В случае книги необходимо указать фамилию и инициалы авторов, название книги, место издания, название издательства, год издания и использованные страницы от и до. Фамилии авторов и название журналов, книг должны приводятся в оригинальной транскрипции.
В экспериментальной части приводятся подробное описание всех приведенных опытов, условия (температура, давление и концентрация веществ и их квалификация) эксперимента, марка прибора, методика синтеза данного соединения [4-7] и другие необходимые сведения. В конце должен быть дан расчет выхода продукта в процентах от теоретически возможного и обсуждение результатов. Индивидуальность синтезированного соединения должна быть доказана идентификацией доступными методами и исследованием его свойств[8].
Выводы должны быть основаны на проделанном эксперименте и содержать основные результаты, полученные в работе. В них очень кратко указывают, какое вещество синтезировано, как установлен его состав, какими методами и какие свойства исследованы.
Литература
1. В.М.Потапов, Э.К.Кочетова Химическая информация. Где и как искать химику нужные сведения. - М.: Химия, 1988.-224с.
2. В.Н Романенко, А.Г.Орлов, Г.В.Никитина Книга для начинающего исследователя-химика.-Л.: Химия, 1987.- 280с.
3. ГОСТ Библиографическое описание произведении печати
4. Руководство по неорганическому синтезу/ Под ред. Г.Брауера. В 6 -ти томах.- М.: Мир, 1985-1986.
5. В.Карякин , И.И.Ангелов Чистые химические реактивы.-М.: Химия, 1974.-408с.
6. И.Г.Ключников Неорганический синтез М.: Просвещение.,1988.-240с.
7. И.Г.Ключников Практикум по неорганическому синтезу.-М.: Просещение.,1988.
8. Справочник Химика / Под ред. Б.П.Никольского. В 6-томах и дополнительный том. -Л.: Химия, 1965 - 1968.
3. Справочные данные
3.1 Некоторые физико-химические величины и единицы СИ
| Величина | Единица СИ |
| Атомная масса (относительная) Ar | атомная единица массы, а.е.м. |
| Вместимость см. Объем | |
| Внутренняя энергия U | джоуль, Дж |
| Волновое число n | метр в минус первой степени, м-1 |
| Время i | cекунда, с |
| Давление r | паскаль, Па |
| Дипольный момент (электрический) m | кулон-метр, Кл-м |
| Диэлектрическая проницаемость (относительная) e | - |
| Длина l | метр, м |
| Длина волны l | метр, м |
| Импульс p | килограмм-метр в секунду, кг.м/с |
| Индуктивность L | генри, Гн |
| Количество вещества n | моль, моль |
| Количество движения см. Импульс | |
| Количество теплоты Q | джоуль, Дж |
| Количество электричества q | кулон, Кл |
| Константа химического равновесия К | |
| Магнитный момент m | ампер-квадратный метр, А.м2 |
| Масса m | килограмм, кг |
| Массовая доля w | - |
| Массовая концентрация r | килограмм на кубический метр, кг/м3 |
| Молекулярная масса (относительная) Mr | атомная единица массы, а.е.м. |
| Мольная доля х | - |
| Моляльная концентрация Cm | моль на килограмм, моль/кг |
| Молярная концентрация С | моль на кубический метр, моль/м3 |
| Молярная масса М | килограмм на моль, кг/моль |
| Молярный объем VМ | кубический метр на моль, м3/моль |
| Объем V | кубический метр, м3 |
| Объемная доля u | - |
| Окислительно-восстановительный потенциал E | вольт, В |
| Период Т см. Время | |
| Плотность r | килограмм на кубический метр, кг/м3 |
| Плотность относительная d | - |
| Площадь А (S) | квадратный метр, м2 |
| Работа W (А) | джоуль, Дж |
| Разность потенциалов DU | вольт, В |
| Растворимости коэффициент ks | - |
| Сила электрического тока I | ампер, А |
| Сродство к протону Ар | джоуль, Дж |
| Сродство к электрону Ае | джоуль, Дж |
| Температура термодинамическая Т | кельвин, К |
| Температура Цельсия t | градус Цельсия, 0С |
| Тепловой эффект химической реакции Q | джоуль, Дж |
| Теплота см. Количество теплоты | |
| Угол плоскости a(b, g , q, j) | радиан, рад |
| Частота n | герц, Гц |
| Электрическая ёмкость С | фарад, Ф |
| Электрическая проводимость l | сименс, См |
| Электрический заряд (относительный) n± (q±, Z±, s±) | элементарный электрический заряд, э.э.з. |
| Электрический потенциал V(j) | вольт, В |
| Электрическое напряжение U | вольт, В |
| Электрическое сопротивление R | ом, Ом |
| Электродвижущая сила DЕ | вольт, В |
| Энергия Е | джоуль, Дж |
| Энергия Гиббса образования вещества DG | джоуль на моль, Дж/моль |
| Энергия Гиббса реакции DG | джоуль, Дж |
| Энергия ионизации I | джоуль, Дж |
| Энтальпия образования вещества DH | джоуль на моль, Дж/моль |
| Энтальпия реакции DH | джоуль, Дж |
| Энтропия вещества S | джоуль на кельвин-моль, Дж/(К.моль) |
| Энтропия реакции DS | джоуль на кельвин, Дж/К |
3.2 Физико-химические постоянные
Скорость распространения электромагнитных колебаний в вакууме с = 2,99792458. 108 м/с.
Магнитная постоянная (магнитная проницаемость вакуума) m0 = 1,256637061 . 10-6 Гн/м
Электрическая постоянная (диэлектрическая проницаемость вакуума) e0 = 8,85418782 . 10-12 Ф/м
Постоянная планка h = 6,626176 . 10-34 Дж/Гц
Постоянная планка h = 6,626176 . 10-34 Дж/Гц
h/2p = 1,0545887 . 10-34 Дж/Гц
Атомная единица массы, а.е.м. mu » 1,6605655 . 10-27кг
Масса покоя электрона me = 9,109534 . 10-31 кг
Масса покоя протона mp = 1,6726485 . 10-27кг
Масса покоя нейтрона mп = 1,6749543 . 10-27 кг
Элементарный электрический заряд e = 1,6021892 . 10-19 Кл
Радиус Бора a0 =5,2917706 . 10-11 м
Масса атома изотопа 1H = 1,673559 . 10-27 кг
Масса атома изотопа 2H(D) = 3,344548 . 10-27 кг
Постоянная Авогадро NA = 6,022045 . 1023 моль-1
Число Авогадро {NA} » 6,02 . 1023(формульных единиц)
Постоянная Фарадея F = 9,648456 . 104 Кл/моль
Универсальная газовая постоянная R = 8,31441 Дж/(К.моль)
Нормальные физические условия:
Нормальное атмосферное давление p = 1,01325 . 105 Па
Нормальная термодинамическая температура T = 273,15 К (или температура Цельсия t = 00С)
Молярный объем идеального газа при нормальных физических условиях VM = 2,241383 . 10-2 м3/моль » 22,4 л/моль
Постоянная Больцмана k = 1,380662 . 10-23 Дж/К
Магнетон Бора mB = 9,274048 . 10-24 А.м2
3.3 Соотношение между единицами величин
Единицы давления:
1 атм (физическая атмосфера, уст.) = 1,01325 . 105 Па
1 мм рт. Ст. (миллиметр ртутного столба, уст.) = 1,33322 . 102 Па
1 Торр (торр, уст) = 1,33322 . 102 Па
1 ат (техническая атмосфера, уст.) = 9,80665 . 104 Па
1 кгс/м2 (килограмм-сила на квадратный метр, уст.) = 9,80665 Па
1 мм вод. Ст. (миллиметр водяного столба, уст.) = 9,80665 Па
Единицы длины:
1 мк (микрон, уст.) = 1 . 10-6 м
1 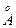 (ангстрем, уст.) = 1 . 10-10 м
(ангстрем, уст.) = 1 . 10-10 м
Единицы массы:
1 т (тонна) = 10 . 103 кг
1 кар (карат) = 2 . 10-4 кг
Единицы объема:
1 л (литр) = 1 . 10-3 м3
Единицы плоского угла:
1о (градус) = (p/180) рад » 1,745329 . 10-2 рад
1¢ (минута) = (p/10800) рад » 2,908882 . 10-4 рад
1² (секунда) = (p/648000) рад » 4,848137 . 10-6 рад
Единицы энергии:
1 эВ (электронвольт) » 1,60218 . 10-19 Дж
1 калтх (термохимическая калория, уст.) = 4,1840 Дж
1 калмежд (международная калория, уст.) = 4,1868 Дж
1 эрг (эрг, уст.) = 1 . 10-7 Дж
1 кгс.м (килограмм-сила-метр, уст.) = 9,80665 Дж
1 л. атм (литр-атмосфера, уст.) = 1,01325 . 102 Дж
1 Вт . ч (ватт-час, уст.) = 3,60 . 103 Дж
Единицы энтропии:
1 э.е. (энтропийная единица, уст.) = 4,1840 Дж/К
3.4. Приставки при образовании кратных
| Наиме-нование | Русское обозна-чение | Множитель | Наимено-вание | Русское обозначение | Множитель |
| Гига | Г | 109 | Деци | д | 10-1 |
| Мега | М | 106 | Санти | с | 10-2 |
| Кило | к | 103 | Милли | м | 10-3 |
| Гекто | г | 102 | Микро | мк | 10-6 |
| Дека | да | 101 | Нано | н | 10-9 |
| Пико | п | 10-12 |
3.5. Растворимость газов в воде (в г на 100 г воды)
| Газ | Температура, 0С | ||||||
| Br2 | 4,22 | 3,4 | 3,2 | 3,13 | |||
| CO2 | 0,3346 | 0,2318 | 0,1688 | 0,1257 | 0,0701 | ||
| Cl2 | 1,46 | 0,98 | 0,716 | 0,562 | 0,386 | 0,219 | |
| H2 | 2,0×10-4 | 1,7.10-4 | 1,6×10-4 | 1,5×10-4 | 1,3×10-4 | 0,8×10-4 | |
| NH3 | 87,5 | 67,9 | 52,6 | 40,3 | 22,9 | ||
| NO | 9,8×10-3 | 7,6×10-3 | 6,2×10-3 | 5,2×10-3 | 3,7×10-3 | 2×10-3 | |
| O2 | 7,0×10-3 | 5,4×10-3 | 4,6×10-3 | 3,5×10-3 | 2,6×10-3 | 1,4×10-3 | |
| HCl | 82,3 | - | - | 67,3 | 59,6 | ||
| H2S | 0,673 | 0,552 | 0,447 | 0,358 |
3.6. Растворимость твердых веществ в воде (в г на 100 г воды)
| Вещество | Твердая фаза | Температура, 0С | ||||||
| Al2(SO4)3 | Al2(SO4)3×18H2O | 23,8 | 25,1 | 26,6 | 31,4 | 87,1 | 42,2 | 47,1 |
| NH 4 NO3 | NH 4 NO3 | 54,2 | 63,9 | 74,8 | 80,2 | 85,9 | 91,0 | |
| (NH 4 )2 SO4 | (NH 4 )2 SO4 | 41,4 | 42,2 | 43,0 | 44,8 | 46,8 | 48,8 | 50,8 |
| NH 4 Cl | NH 4 Cl | 23,0 | 25,1 | 27,1 | 31,5 | 35,6 | 39,6 | 43,6 |
| NH 4 HCO3 | NH 4 HCO3 | 10,9 | 13,7 | 17,5 | 24,2 | |||
| (NH 4)2 CO3 | (NH 4)2 CO3×H2O | 22,5 | ||||||
| KNO3 | KNO3 | 11,6 | 17,7 | 24,1 | 39,1 | 52,5 | 62,8 | 71,1 |
| KAl(SO4)2 | KAl2(SO4)2×12H2O | 3,1 | 4,4 | 5,7 | 12,0 | 26,7 | 71,4 | |
| K2 Cr 2O7 | K2 Cr 2O7 | 4,4 | 7,5 | 1,11 | 20,6 | 31,2 | 41,1 | 50,5 |
| K2 S2O8 | K2 S2O8 | 1,62 | 2,60 | 4,49 | 9,89 | |||
| K2 SO4 | K2 SO4 | 6,9 | 8,5 | 10,0 | 13,1 | 15,4 | 17,6 | 19,4 |
| KCl | KCl | 22,2 | 23,8 | 28,7 | 31,3 | 33,8 | 36,0 | |
| Ca(CH3COO)2 | Ca(CH3COO)2 | 37,4 | 36,0 | 34,7 | 33,2 | 32,7 | 33,5 | 29,7 |
| CoCl2 | CoCl2×6H2O | 30,2 | 31,0 | 34,9 | 39,4 | 48,4 | ||
| CoCl2×12H2O | 49,0 | 50,7 | ||||||
| MgCl2 | MgCl26H2O | 34,5 | 34,8 | 35,3 | 36,5 | 37,9 | 39,7 | 42,2 |
| MnCl2 | MnCl2×6H2O | 38,9 | 42,4 | 47,1 | 52,1 | 52,0 | 53,7 | |
| CuCl2 | CoCl2×2NH4Cl× 2H2O | 22,2 | 26,0 | 30,5 | 36,1 | 43,4 | ||
| CuSO4 | CoSO4 ×5H2O | 12,9 | 13,2 | 17,5 | 22,8 | 28,1 | 34,9 | 42,4 |
| Na2 SO4 | Na2 SO4×10H2O | 4,5 | 8,2 | 16,1 | 32,5 | |||
| Na2 SO4 | 30,2 | 30,0 | ||||||
| Na2 SO4×7H2O | 16,4 | 23,4 | 32,5 | |||||
| Na2 B4 O7 | Na2 B4O7×10H2O | 1,18 | 1,76 | 2,58 | 6,0 | 16,6 | ||
| Na2 B4 O7×10H2O | 23,4 | 34,6 | ||||||
| Na2 CO3 | Na2 O3×10H2O | 6,6 | 17,8 | 33,2 | ||||
| NaHCO3 | NaHCO3 | 6,45 | 7,58 | 8,76 | 14,9 | |||
| NaCl | NaCl | 26,2 | 26,5 | 26,8 | 27,1 | 27,6 | 28,4 | |
| Ni(NO3)2 | Ni(NO3)2×6H2O | 44,3 | 49,1 | 54,8 | 62,0 | |||
| Ni(NO3)2×6H2O | 63,0 | |||||||
| H2 B O3 | H2 BO3 | 2,50 | 3,52 | 5,4 | 9,5 | 27,5 |
3.7 Растворимость неорганических веществ в
воде при комнатной температуре
| Ионы | Br- | CH3COO- | CN- | CO32- | Cl- | F- | I- | NO3- | OH- | PO43- | S2- | SO42- |
| Ag+ | н | м | н | н | н | р | н | р | - | н | н | м |
| Al3+ | р | + | ? | - | р | м | р | р | н | н | + | р |
| Ba2+ | р | р | р | н | р | м | р | р | р | н | р | н |
| Be2+ | р | + | ? | н* | р | р | р | р | н | н | + | р |
| Bi3+ | + | + | - | - | + | н | н | + | н | н | н | + |
| Ca2+ | р | р | р | н | р | н | р | р | м | н | р | м |
| Cd2+ | р | р | м | н* | р | р | р | р | н | н | н | р |
| Co2+ | р | р | н | н* | р | р | р | р | н | н | н | р |
| Cr3+ | р | + | н | - | р | м | н | р | н | н | н* | р |
| Cs+ | р | р | р | р | р | р | р | р | р | р | р | р |
| Cu2+ | р | р | н | н* | р | р | - | р | н | н | н | р |
| Fe2+ | р | р | н | н | р | м | р | р | н | н | н | р |
| Fe3+ | р | - | н | - | р | н | - | р | н | н | + | р |
| H+ | р | ¥ | ¥ | м | р | р | р | ¥ | ¥ | р | м | ¥ |
| Hg2+ | м | р | р | - | р | + | н | + | - | н | н | + |
| Hg22+ | н | м | - | н | н | м | н | + | - | н | - | н |
| K+ | р | р | р | р | р | р | р | р | р | р | р | р |
| Li+ | р | р | р | р | р | н | р | р | р | м | р | р |
| Mg2+ | р | р | р | м | р | м | р | р | н | н | н | р |
| Mn2+ | р | р | н | н* | р | р | р | р | н | н | н | р |
| NH4+ | р | р | р | р | р | р | р | р | р | р | - | р |
| Na+ | р | р | р | р | р | р | р | р | р | р | р | р |
| Ni2+ | р | р | н | н* | р | р | р | р | н | н | н | р |
| Pb2+ | м | р | н | н* | м | м | м | р | н | н | н | н |
| Rb+ | р | р | р | р | р | р | р | р | р | р | р | р |
| Sn2+ | + | + | - | - | + | р | м | + | н | н | н | + |
| Sr2+ | р | р | р | н | р | н | р | р | м | н | р | н |
| Tl+ | м | р | р | р | м | р | н | р | р | н | н | м |
| Zn2+ | р | р | н | н* | р | м | р | р | н | н | н | р |
Обозначения: р – хорошо растворимый, м – малорастворимый, н – практически нерастворимый, ¥ - неограниченно растворимый, + - полностью реагирует с водой, - - не существует, * - осадок из водного раствора не образуется вследствие полного гидролиза, ? – отсутствуют данные по растворимости.
3.8. Криоскопические константы К и эбулископические Е постоянные
| Растворитель | Температура замерзания, 0С | Е | Температура кипения, 0С | Е |
| Вода | 1,86 | 0,52 | ||
| Бензол | 5,5 | 5,10 | 80,2 | 2,57 |
| Анилин | -6 | 5,87 | 184,4 | 3,69 |
| Уксусная кислота | 16,7 | 3,90 | 118,4 | 3,10 |
| Четыреххлористый углерод | -23 | 29,80 | 76,7 | 5,30 |
3.9. Плотность некоторых соединений
| Вещество | Формула | Плотность, г/см3 | t, 0С |
| Аммоний хлорид | NH4Cl | 1,53 | |
| Кремний хлорид | SiCl4 | 1,52 | |
| Натрий хлорид | NaCl | 2,163 | 15-20 |
| Олово (IV) хлорид | SnCl4 | 2,278 | |
| Сахар | C12H22O11 | 1,558 | |
| Сера монохлорид | S2Cl12 | 1,68 | |
| Сульфурил хлорид | SO2Cl2 | 1,67 | |
| Сурьма (III) хлорид | SbCl3 | 3,064 | |
| Тионил хлорид | SOCl2 | 1,675 | |
| Титан (IV) хлорид | Ti Cl4 | 1,76 | |
| Углерод тетрахлорид | CCl4 | 1,632 | |
| Фосфор (III) бромид | PBr3 | 2,85 | |
| Фосфор (III) хлорид | PCl3 | 1,57 | |
| Фосфор (V) хлороксид | POCl3 | 1,69 |
3.10. Концентрация и плотность кислот и оснований при 200С
| % | H2SO4 | HCl | HNO3 | H3PO4 | CH3CO OH | NaOH | KOH | NH3 раствор |
| 1,005 | 1,003 | 1,004 | 1,004 | 1,000 | 1,010 | 1,007 | 0,994 | |
| 1,012 | 1,008 | 1,009 | 1,009 | 1,001 | 1,021 | 1,017 | 0,990 | |
| 1,018 | 1,013 | 1,015 | 1,015 | 1,003 | 1,032 | 1,026 | 0,985 | |
| 1,025 | 1,018 | 1,020 | 1,020 | 1,004 | 1,043 | 1,035 | 0,981 | |
| 1,032 | 1,023 | 1,026 | 1,026 | 1,006 | 1,054 | 1,044 | 0,977 | |
| 1,039 | 1,028 | 1,031 | 1,031 | 1,007 | 1,065 | 1,053 | 1,973 | |
| 1,045 | 1,033 | 1,037 | 1,037 | 1,008 | 1,076 | 1,062 | 1,969 | |
| 1,052 | 1,038 | 1,043 | 1,042 | 1,010 | 1,087 | 1,072 | 1,965 | |
| 1,59 | 1,043 | 1,049 | 1,048 | 1,011 | 1,098 | 1,081 | 1,961 | |
| 1,066 | 1,047 | 1,054 | 1,053 | 1,013 | 1,109 | 1,090 | 1,958 | |
| 1,080 | 1,057 | 1,066 | 1,065 | 1,015 | 1,131 | 1,109 | 0,950 | |
| 1,095 | 1,068 | 1,078 | 1,076 | 1,018 | 1,153 | 1,128 | 0,943 | |
| 1,109 | 1,078 | 1,090 | 1,088 | 1,021 | 1,175 | 1,148 | 0,936 | |
| 1,124 | 1,088 | 1,103 | 1,101 | 1,024 | 1,197 | 1,167 | 0,930 | |
| 1,139 | 1,098 | 1,115 | 1,113 | 1,026 | 1,219 | 1,186 | 0,923 | |
| 1,155 | 1,108 | 1,128 | 1,126 | 1,029 | 1,241 | 1,206 | 0,916 | |
| 1,170 | 1,119 | 1,140 | 1,140 | 1,031 | 1,263 | 1,226 | 0,910 | |
| 1,186 | 1,129 | 1,153 | 1,153 | 1,034 | 1,285 | 1,247 | 0,904 | |
| 1,202 | 1,139 | 1,167 | 1,167 | 1,036 | 1,306 | 1,267 | 0,898 | |
| 1,219 | 1,149 | 1,180 | 1,181 | 1,038 | 1,328 | 1,288 | 0,892 | |
| 1,260 | 1,174 | 1,214 | 1,214 | 1,044 | 1,380 | 1,341 | ||
| 1,303 | 1,198 | 1,246` | 1,254 | 1,049 | 1,430 | 1,396 | ||
| 1,348 | 1,278 | 1,293 | 1,053 | 1,478 | 1,452 | |||
| 1,395 | 1,310 | 1,335 | 1,058 | 1,525 | 1,511 | |||
| 1,395 | 1,339 | 1,379 | 1,061 | |||||
| 1,498 | 1,367 | 1,379 | 1,061 | |||||
| 1,553 | 1,391 | 1,476 | 1,067 | |||||
| 1,611 | 1,413 | 1,526 | 1,069 | |||||
| 1,669 | 1,434 | 1,579 | 1,070 | |||||
| 1,727 | 1,452 | 1,633 | 1,070 | |||||
| 1,779 | 1,469 | 1,689 | 1,069 | |||||
| 1,814 | 1,483 | 1,746 | 1,066 | |||||
| 1,824 | 1,487 | 1,770 | 1,064 | |||||
| 1,831 | 1,491 | 1,794 | 1,062 | |||||
| 1,936 | 1,495 | 1,819 | 1,059 | |||||
| 1,836 | 1,501 | 1,844 | 1,055 | |||||
| 1,831 | 1,513 | 1,870 | 1,050 |
3.11. Значения ионного произведения воды (Кw)
| Температура, 0С | Ионное произведение воды, Кw | рН |
| 0,11.10-14 | 7,48 | |
| 1,00.10-14 | 7,00 | |
| 55,00.10-14 | 6,13 |
3.12. Константы диссоциации кислот (250С)
| Кислота | Формула | Кдисс |
| Азотистая | HNO2 | 5,1.10-14 |
| Азотистоводородная | HN3 | 1,9.10-5 |
| Борная | H3BO3 | 5,8.10-10 |
| Тетраборная | H2B4O7 | 1,5.10-7 |
| Бромноватистая | HBrO | 2,5.10-9 |
| Йодная | HIO4 | 2,8.10-2 |
| Йодноватая | HIO4 | 1,6.10-1 |
| Йодноватистая | HIO | 2,3.10-11 |
| Кремниевая | H4SiO4 | 1,3.10-11 |
| Муравьиная | HCOOH | 1,8.10-4 |
| Мышьяковая | H3AsO4 | 6,0.10-3 |
| Мышьяковистая | H3AsO3 | 5,1.10-10 |
| Пероксид водорода | H2O2 | 2,0.10-12 |
| Селенистая | H2 SeO3 | 2,4.10-3 |
| Селеновая (К2) | H2 SeO4 | 1,3.10-2 |
| Селенистоводородная | H2 Se | 1,3.10-4(K1) |
| Серная (К2) | H2 SO4 | 1,2.10-2 |
| Сернистая | H2 SO3 | 1,7.10-2 |
| Сероводородная | H2 S | 1,0.10-7 |
| Теллуристая (К1) | H2 TeO3 | 2,7.10-3 |
| Теллуровая (К1) | H6TeO6 | 2,0.10-8 |
| Теллуристоводородная | H2Te | 2,3.10-3 |
| Тиосерная | H2 S2 O3 | 2,5.10-1 |
| Угольная | H2 CO3 | 4,5.10-7 |
| Уксусная | CH3 COOH | 1,7.10-5 |
| Фосфорноватистая | H3PO2 | 8,0.10-2 |
| Фосфористая | H3PO3 | 1,6.10-2(K1) 2,0.10-7(K2) |
| Фосфорная (орто) | H3PO4 | 7,6.10-2 6,2.10-8 1,2.10-13 |
| Фтористоводородная | HF | 6,8.10-4 |
| Хлорноватистая | HClO | 5,0.10-8 |
| Хлористая | HClO2 | 1,1.10-1 |
| Хромовая (К1) | H2CrO4 | 9,0.10-17 |
| Цианистоводородная | HCN | 6,2.10-10 |
| Щавелевая | H2C2O4 | 5,6.10-2(K1) 5,6.10-5(K2) |
| Вода | H2O | 1,8.10-16 |
3.13. Константы диссоциации оснований (250С)
| Основание | Формула | Кдисс |
| Алюминия гидроксид (К1) | Al(OH)3 | 1,0.10-9 |
| Аммиака гидрат | NH3H2O | 1,8.10-5 |
| Бария гидроксид (К2) | Ba(OH)2 | 2,3.10-1 |
| Бериллия гидроксид (К2) | Be(OH)2 | 5,0.10-11 |
| Гидразин | N2H4H2O | 9,8.10-7 |
| Гидраксиламин | NH2OH | 1,8.10-5 |
| Железа (II) гидроксид (К2) | Fe(OH)2 | 2,3.10-7 |
| Железа (III) гидроксид (К2) | Fe(OH)3 | 2,3.10-7 |
| Кальция гидроксид (К2) | Ca(OH)2 | 4,0.10-2 |
| Кобальта (III) гидроксид | Co(OH)3 | 7,0.10-13 |
| Лития гидроксид | LiOH | 6,8.10-1 |
| Магния гидроксид (К2) | Mg(OH)2 | 2,5.10-3 |
| Марганца (II) гидроксид (К2) | Mn(OH)2 | 5,0.10-4 |
| Меди (II) гидроксид (К2) | Cu(OH)2 | 7,9.10-14 |
| Свинца гидроксид | Pb(OH)2 | 9,6.10-4 3,0.10-8 |
| Серебра (I) гидроксид | AgOH | 5,0.10-3 |
| Стронция гидроксид (К2) | Sr(OH)2 | 1,6.10-1 |
| Хрома (III) гидроксид (К3) | Cr(OH)3 | 7,0.10-31 |
| Цинка гидроксид | Zn(OH)2 | 4,4.10-5 2,0.10-9 |
3.14. Стандартные электродные потенциалы металлов
| Металл | Е0, В | Металл | Е0, В | Металл | Е0, В |
| Li+/Li | -3.045 | Be2+/Be | -1.847 | Pb2+/Pb | -1.126 |
| Rb+/Rb | -2.925 | Al3+/Al | -1.700 | H+/H2 | ±0.000 |
| K+/K | -2.924 | Ti3+/Ti | -1.208 | SbIII/Sb | +0.240 |
| Cs+/Cs | -2.923 | Mn2+/Mn | -1.192 | ReIII/Re | +0.300 |
| Ra2+/Ra | -2.916 | Cr2+/Cr | -0.852 | BiIII/Bi | +0.317 |
| Ba2+/Ba | -2.905 | Zn2+/Zn | -0.763 | Cu2+/Cu | +0.338 |
| Sr2+/Sr | -2.888 | Ga3+/Ga | -0.560 | Ru2+/Ru | +0.450 |
| Ca2+/Ca | -2.864 | Fe2+/Fe | -0.441 | Ag+/Ag | +0.799 |
| Na+/Na | -2.711 | Cd2+/Cd | -0.404 | Rh3+/Rh | +0.800 |
| Ac3+/Ac | -2.600 | In3+/In | -0.338 | Hg2+/Hg | +0.852 |
| La3+/La | -2.522 | Co2+/Co | -0.277 | Pd2+/Pd | +0.915 |
| Mg2+/Mg | -2.372 | Ni2+/Ni | -0.234 | PtII/Pt | +0.963 |
| Sc3+/Sc | -2.370 | Sn2+/Sn | -0.141 | Au+/Au | +1.691 |
3.15. Произведение растворимости (ПР) (18-250С)
| Соединений | Формула | ПР |
| Алюминия гидроксид | Al(OH)3 | 1,0.10-32 |
| Бария сульфат | BaSO4 | 1,0.10-10 |
| Бария карбонат | BaCO4 | 5,1.10-9 |
| Бария хромат | BaCrO4 | 1,2.10-10 |
| Бария гидроксид | Ba(OH)2 | 5,0.10-3 |
| Бария манганат | BaMnO4 | 2,5.10-10 |
| Бериллия гидроксид | Be(OH)2 | 6,3.10-22 |
| Висмута гидроксид | Bi(OH)3 | 3,2.10-32 |
| Висмута сульфид | Bi2 S3 | 1,0.10-97 |
| Железа (II)гидроксид | Fe(OH)2 | 1,0.10-15 |
| Железа (III)гидроксид | Fe(OH)3 | 3,2.10-328 |
| Железа (II) сульфид | FeS | 5,0.10-18 |
| Железа (II) карбонат | FeCO3 | 3,5.10-11 |
| Кадмия гидроксид | Cd(OH)2 | 2,2.10-14 |
| Кадмия сульфид | CdS | 7,9.10-27 |
| Кальция гидроксид | Ca(OH)2 | 5,5.10-6 |
| Кальция гидрофосфат | CaHPO4 | 2,7.10-7 |
| Кальция фосфат | Ca3(PO4)2 | 2,0.10-29 |
| Кальция карбонат | CaCO3 | 4,8.10-9 |
| Кальция сульфат | CaSO4 | 9,1.10-6 |
| Лития гидроксид | LiOH | 4,0.10-2 |
| Лития карбонат | Li2CO3 | 4,0.10-3 |
| Магния гидроксид | Mg(OH)2 | 1,1.10-11 |
| Марганца гидроксид | Mn(OH)2 | 1,6.10-13 |
| Марганца сульфид (роз.) | MnS | 2,5.10-10 |
| Меди гидроксид | CuOH | 1,0.10-14 |
| Меди (II)гидроксид | Cu(OH)2 | 2,2.10-20 |
| Меди (I) хлорид | CuCI | 1,2.10-6 |
| Меди (I) бромид | CuBr | 5,2.10-9 |
| Меди (I) йодид | CuI | 1,1.10-12 |
| Меди (I)сульфид | Cu2S | 2,5.10-48 |
| Меди (II)сульфид | CuS | 6,3.10-36 |
| Никеля сульфид | NiS | 1,0.10-24 |
| Олова (II) гидроксид | Sn(OH)2 | 1,4.10-28 |
| Олова (IV)гидроксид | Sn(OH)4 | 1,0.10-57 |
| Олова (II) сульфид | SnS | 1,0.10-25 |
| Ртути (II)сульфид | HgS | 1,6.10-52 |
| Ртути (I) хлорид | Hg2Cl2 | 1,3.10-18 |
| Свинца (II)гидроксид | Pb(OH)2 | 8,7.10-14 |
| Свинца (II)сульфат | PbSO4 | 1,6.10-8 |
| Свинца сульфид | PbS | 2,5.10-27 |
| Свинца хлорид | PbCl2 | 1,6.10-5 |
| Свинца йодид | PbI2 | 1,1.10-9 |
| Серебра (I)гидроксид | AgOH | 1,6.10-8 |
| Серебра бромид | AgBr | 5,3.10-13 |
| Серебра йодид | AgI | 8,3.10-17 |
| Серебра сульфид | Ag2S | 6,3.10-50 |
| Серебра фосфат | Ag3PO4 | 1,3.10-20 |
| Серебра хлорид | AgCl | 1,8.10-10 |
| Серебра ванадат | AgVO3 | 5,0.10-7 |
| Стронция гидроксид | Sr(OH)2 | 1,4.10-3 |
| Стронция карбонат | SrCO3 | 1,1.10-10 |
| Стронция сульфат | SrSO4 | 3,2.10-7 |
| Сурьмы (III) гидроксид | Sb(OH)3 | 4,0.10-42 |
| Сурьмы (III) сульфид | Sb2S3 | 1,6.10-93 |
| Хрома (II) гидроксид | Cr(OH)2 | 1,0.10-17 |
| Хрома (III) гидроксид | Cr(OH)3 | 6,3.10-31 |
| Цинка гидроксид | Zn(OH)2 | 7,1.10-18 |
| Цинка сульфид | ZnS | 1,6.10-24 |
3.16. Константы неустойчивости некоторых комплексных ионов
| Уравнение диссоциации комплексного иона | Константа неустойчивости |
| [Ag(CN)2]- Û 2Ag++ 2CN- | 1,0.10-21 |
| [Ag(NH3)2]+ Û Ag++ 2NH3 | 5,89.10-8 |
| [Ag(S2 O3]3- Û Ag++ 2S 2O32- | 1,00.10-18 |
| [AlF6]3- Û 2Ag3++6F- | 5,01.10-18 |
| [Cd(CN)4]2- Û Cd2++ 4CN- | 7,66.10-7 |
| [Cdl4]2- Û Cd2++ 4l- |
Генерация страницы за: 0.052 сек.
