Механизмы замещения ароматически связанного галогена
Для объяснения хода реакции в этом случае был предложен механизм «отщепления – присоединения», который заключается в следующем.
Предполагается, что как и в реакции элиминирования Е2 в алкилгалогенидах, сильноосновный амид-ион NH2- отрывает водородный атом от того атома углерода бензольного кольца, который соседствует с другим углеродом, связанным с галогеном. При этом сразу же или в отдельной стадии молекулу покидает анион хлора. После этого бензол приобретает углерод с неподеленной парой электронов, по соседству с которым находится другой углерод с вакантной орбиталью. Между ними возникает еще одна связь
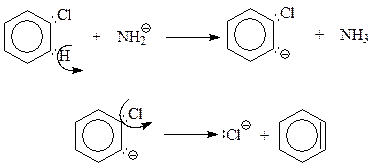
Так завершается стадия элиминирования процесса, приводящая к непривычной структуре – бензолу с тройной связью, который называется дегидробензолом
В дегидробензоле дополнительная связь возникает в результате бокового перекрывания гибридных sp2-орбиталей в плоскости, перпендикулярной ароматическому секстету.
Несмотря на достаточно нелепое строение дегидробензол, по-видимому, действительно существует. Во-первых, он был получен при очень низких температурах (-2650С) в среде аргона. Удалось даже снять его ИК-спектр, подтвердивший приписываемое ему строение бензольного кольца с тройной связью. Во-вторых, удалось осуществить реакцию Дильса-Альдера, в которой диенофилом выступал дегидробензол, а диеном – фуран
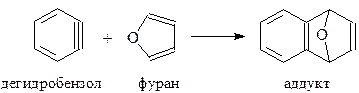
В дальнейшем высокореакционноспособный дегидробензол присоединяет нуклеофил – амид-анион - к одному из углеродов тройной связи, размещенному в бензольном кольце
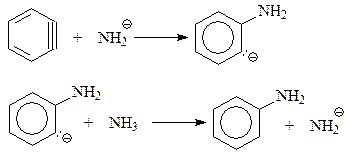
Рассмотренный механизм применим для объяснения реакции нуклеофильного замещения в случае, когда бензольное кольцо не содержит никаких других заместителей, кроме галогена. По механизму «элиминирования – присоединения» протекают, по-видимому, и реакции с арилгалогенидами, которые в кольце содержат еще какие-то заместители, способные подавать электроны. Раньше они были объединены в одну группу как заместители 1 рода или электронодонорные заместители.
А вот для объяснения течения реакций замещения с участием арилгалогенидов, содержащих в кольце электроноакцепторные заместители, был предложен другой механизм, который называется бимолекулярным механизмом. Примеры таких реакций, которые возможно протекают по этому механизму, были приведены раньше (см. гидролиз нитрохлорбензолов). В этом случае нам необходимо объяснить активирующее влияние электроноакцепторных заместителей вообще и зависимость этого влияния от расположения их в кольце.
Предполагается, что при бимолекулярном механизме на первой стадии реакции нуклеофильная частица атакует арилгалогенид с образованием карбаниона. В этом ионе возникает связь между нуклеофилом и углеродом бензольного кольца, несущем атом галогена. Связь образуется за счет электронной пары нуклеофила. В образовавшемся карбанионе: бензол перестает быть ароматическим; углерод, связанный с галогеном становится sp3-гибридизованным, в кольце на пять углеродов, не изменивших гибридизацию, приходится шесть электронов. Лишний электрон принадлежит в целом системе, а не одному из углеродов кольца. Это обстоятельство отображается в формуле карбаниона полукругом. В целом бимолекулярный механизм включает следующие элементарные стадии
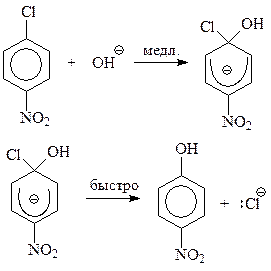
Какие же имеются аргументы в пользу предложенного механизма? Откуда следует, что реакция протекает в две элементарные стадии?
В реакции замещения разрывается связь между углеродом кольца и атомом галогена. В общем случае эта связь может раскрыться до образования новой связи вместо разрушенной (как в реакции SN1), синхронно (SN2), или уже после образования новой связи. Установление момента разрыва связи между галогеном и углеродом, при котором происходит замещение, для аргументации механизма реакции имеет важнейшее значение. Обычно для получения ответа используется кинетический изотопный эффект.
У нас уже имеется опыт использования кинетического изотопного эффекта при изучении механизма электрофильного замещения в ароматическом ряду. Не повторяясь полностью на рассмотрении явления кинетического изотопного эффекта, полезно будет все же вспомнить о связи этого явления с механизмом реакции. Эта связь сводится к следующему. Если реакция идет с изотопным кинетическим эффектом, то это означает, что интересующая нас химическая связь разрывается на лимитирующей стадии реакции. Отсутствие кинетического изотопного эффекта свидетельствует о разрыве связи в быстрой стадии реакции, которой должна предшествовать медленная стадия. К сожалению, использовать кинетический изотопный эффект в классическом его варианте с применением изотопов галогена, в случае нуклеофильного замещения ароматически связанного галогена, не представляется возможным. Поскольку в рассматриваемом случае изучается связь между углеродом и галогеном, а не между углеродом и водородом, нам пришлось бы выявлять наличие или отсутствие кинетического изотопного эффекта в реакциях с различными изотопами галогенов. В отличие от изотопов водорода, изотопы галогенов по массе отличаются весьма незначительно. Следовательно, они также незначительно будут отличаться и по реакционной способности, а экспериментальные данные, полученные с их использованием, окажутся малоинформативными. Кажется, что при изучении замещения ароматически связанного галогена кинетический изотопный эффект не поможет. Оказалось, что это не совсем так.
Остроумный выход из положения указал Дж. Баннет.Он предложил вместо изотопов одного галогена использовать разные галогены. А они как по массе, так и по прочности связи с углеродом отличаются весьма существенно. Тем не менее, установлено, что галогенпроизводные ароматического ряда с различными галогенами в бензольном кольце в реакциях нуклеофильного замещения проявляют лишь очень небольшое различие в реакционной способности. Этот факт однозначно свидетельствует о разрыве связи углерод-галоген в рассматриваемых реакциях в быстрой стадии, в стадии образования продукта реакции.
Подобное течение реакции и образование карбаниона обусловлены присутствием в молекуле арилгалогенида электроноакцепторного заместителя. Этот заместитель оттягивает электроны от бензольного кольца и способствует повышению устойчивости карбаниона. Это особенно хорошо видно, если карбанион представить как резонансный гибрид нескольких предельных структур
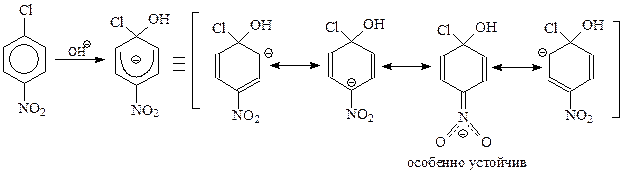
Стабильность карбаниона связана с участием в гибридизации канонической структуры с отрицательным зарядом на кислородах. Поскольку кислород легко принимает отрицательный заряд, эта структура отличается особой устойчивостью.
Устойчивость карбанионов рассматриваемого типа настолько велика, что иногда их даже удается выделить. Этот уникальный случай в органической химии произошел при попытке заместить этокси–группу в 2,4,6-фенетоле на метокси–группу при помощи метилата калия (1902 г., Мейзенгеймер)
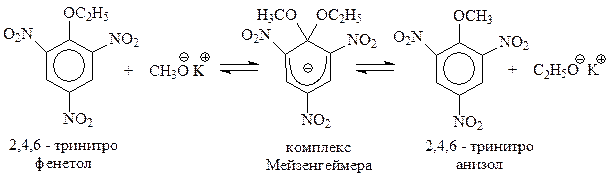
Анион был выделен в виде твердого продукта красного цвета. В честь исследователя анионы такого типа называют комплексами Мейзенгеймера.
Итак, нуклеофильное замещение ароматически связанного галогена по бимолекулярному механизму протекает в две стадии, с образованием карбаниона на медленной стадии и разрывом связи между углеродом и галогеном – на быстрой стадии замещения.
Согласуется ли предложенный механизм с характером влияния электроноакцепторных заместителей на ход реакции?
Как было показано выше, на лимитирующей стадии нуклеофильного замещения образуется карбанион. Понятно, что любой акцептор электронов (заместители 2 рода), а не только нитрогруппа, оттягивает электроны от бензольного кольца, стабилизирует анион и способствует реакции. Электронодонорные заместители (заместители 1 рода), напротив, подают электроны к кольцу, дестабилизируют карбанион и затрудняют замещение. Сказанное может быть представлено следующей схемой

Интересно, что особенно сильно влияние электроноакцепторной группы ощущается в случае нахождения ее в о- и п-положениях по отношению к галогену.
Рассмотрим два случая с участием в реакции п- и м-нитрохлорбензолов. В рамках бимолекулярного механизма ход реакции в каждом случае можно представить схемами
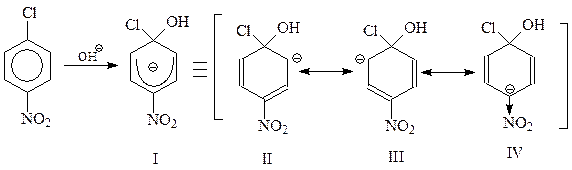
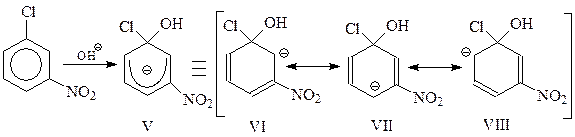
Из двух карбанионов, образующихся из п-нитрохлорбензола I и м-нитрохлорбензола V, более устойчивым будет I. При изображении этого иона в виде резонансного гибрида нескольких предельных структур II – IV видно, что в этом случае свой вклад вносит особенно устойчивая каноническая структура IV. В этой структуре нитрогруппа оттягивает электроны не просто от кольца, а наиболее эффективным способом – конкретно от углерода кольца, несущего отрицательный заряд.
Нетрудно видеть, что в случае участия в реакции м-нитрохлорбензола возможность образования канонической структуры типа IV исключается.
Итак, I устойчивее V, следовательно, этот карбанион будет быстрее образовываться. Однако такого типа карбанионы могут получаться лишь при о- и п-расположении электроноакцепторных заместителей в кольце.
Интересно отметить, что под влиянием электроноакцепторных групп приобретает высокую реакционную способность даже фтор во фторбензолах. Например, один из них – 2,4-динитрофторбензол - широко применяется при изучении N-концевых групп аминокислот и пептидов (реактив Сенгера). Не надо думать, что замещаться в ароматических соединениях могут только галогены. Под влиянием электроноакцепторных групп такую способность приобретают даже те атомы и группы атомов, для которых участие в реакции замещения совсем не характерно (NO2, COOH и др.). Эти случаи будут подробнее рассмотрены при изучении нитросоединений.
Дата добавления: 2014-12-24; просмотров: 4030;
