ТЕПЛОЕМКОСТЬ ГАЗОВ
Теплоемкостью называется то количество тепла, которое необходимо подвести к единице количества вещества (или отвести от него), чтобы изменить его температуру на 1°. Это количество тепла измеряется энергетическими единицами — калорией и джоулем (дж); в технических расчетах чаще применяются более крупные единицы —
|
килокалория (ккал) и килоджоуль (кдж). Соотношение между единицами теплоты в системах МКГСС и СИ следующее:
1 ккал = 426,9 .9,80665 = 4186,5 дж = 4,1865 кдж;
1 кдж = 0,2388 ккал.
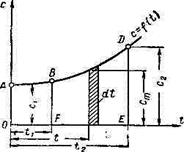
| Рис. 3 Зависимость теплоемкости газа от температуры |
Теплоемкость идеальных газов зависит от многих факторов: физических свойств газов, характера процесса, при котором происходит подвод или отвод тепла, и температуры.
Теплоемкость реальных тазов зависит, кроме того, от давления.
График зависимости теплоемкости газа от температуры представлен на рис. 2
Чтобы нагреть рабочее тело (газ) от температуры t до температуры t + dt, необходимо подвести тепло dq; при этом
dq = cdt, [24]
отсюда с= 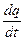 [25]
[25]
где dq— элементарное количество тепла, подведенное к единице количества газа (моль, кг, нм3*).
*объем взят при нормальных физических условиях
Характеризуемая равенством [25] величина спредставляет собой теплоемкость газа при бесконечно малом изменении t. Полученное значение с называется истинной теплоемкостью при температуре t.
Из формулы [24] следует, что для нагрева газа от температуры t1 до t2 необходимо количество тепла, выражение для которого можно записать так:
q= 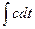
следовательно, количество подведенного тепла графически измеряется площадью под кривой функции c = f(t). Если эту площадь заменить равновеликим прямоугольником с высотой ст, то количество подведенного тепла определится по формуле
q = Сm (t2 – t1) [26]
Величина ст называется средней теплоемкостью; ее числовое значение зависит от двух крайних температур.
Криволинейную зависимость теплоемкости от температуры для двухатомных газов можно заменить прямолинейной:
c=co+ at;
Cm = C0 + 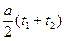
где с0 — теплоемкость газа при t = 0° С;
а — постоянный для каждого газа коэффициент, показывающий приращение теплоемкости при повышении температуры на 1°.
Для упрощения теплотехнических расчетов, не требующих большой точности (при невысоких температурах газов), теплоемкость принимают постоянной.
В зависимости от выбранной количественной единицы газа различают массовую с, объемную с' и мольную μc теплоемкости. Из определения теплоемкости следует, что для нагревания массы G кг от температуры t1 до температуры t2 потребуется тепла
Q = Gc(t2 — tt) ккал или дж. [27]
Если количество газа выражается в объемных единицах (нм3), то количество тепла, необходимого для нагревания его от температуры t1 до температуры t2, можно подсчитать по формуле
Q = Vс'(t2 — t1) ккал или дж. [28]
Если же количество газа выражается в молях, то
Q = μc G/μ (t2-t1) ккал или дж.
Массовая, объемная и мольная теплоемкости связаны между собой следующими зависимостями:
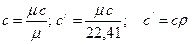
Величина теплоемкости газа зависит от условий, при которых тепло подводится или отводится. В технике наиболее важное значение имеют два способа подвода тепла: 1) при постоянном объеме газа (v = const);
2) при постоянном давлении газа (р = const). Теплоемкость в первом случае называется изохорной, а во втором — изобарной. Изохорная и изобарная теплоемкости могут быть массовыми, объемными и мольными и соответственно обозначаются cv, cp, cv/, cp/, μcv, μcp.
Поясним сказанное на примере. Возьмем два цилиндра, в которых содержится по 1 кг одного и того же газа при одинаковых начальных температурах, но в левом цилиндре поршень может передвигаться, а в правом он закреплен неподвижно. Поэтому при нагревании газа в обоих цилиндрах объем газа в левом цилиндре увеличится, а в правом остается неизменным.
Газ при сохранении его объема неизменным не совершает работы, поэтому все подводимое тепло расходуется на повышение температуры. При сохранении неизменным давления подводимое тепло расходуется не только на повышение температуры, но и на преодоление постоянной силы Р, т. е. совершается работа.
Из рассмотрения этих двух способов подвода тепла к газу следует, что для нагревания на 1° газа в левом цилиндре тепла потребуется подвести больше, чем к газу, содержащемуся в правом цилиндре; следовательно, изобарная теплоемкость всегда больше изохорной: cp >cv.
Связь между этими теплоемкостями устанавливается уравнением Майера
ср-сv = AR
Теплоемкости смеси газов могут быть определены по формулам:
массовая
ссм =g1c1+g2c2+g3c3 +…+ gncn = ∑gici
объемная
с/см = с1r1+c2r2+c3r3 +…+cnrn = ∑ciri
Дата добавления: 2014-12-24; просмотров: 1675;
