СМЕСИ ИДЕАЛЬНЫХ ГАЗОВ
В теплотехнике гораздо чаще приходится иметь дело не с однородным газом, а со смесью нескольких газов (например, воздух, природный газ, продукты сгорания топлива и др.). Под смесью идеальных газов понимается механическая смесь различных газов при условии отсутствия в них химических реакций, т. е. химически между собой не взаимодействующих. Каждый компонент, входящий в состав смеси, ведет себя независимо от других газов, занимает полный объем смеси, имеет одинаковую со смесью температуру и оказывает на стенки сосуда свое давление, которое называется парциальным. Смесь идеальных газов также является идеальным газом и подчиняется всем законам, относящимся к идеальным газам.
Давление смеси газов определяют на основе закона Дальтона, по которому общее давление смеси равно сумме парциальных давлений компонентов, составляющих смесь, т. е. n
Рсм = Р1 + Р2 + Р3 +…+Рn = ∑ Pi [18]
1
где P1,P2,р3,..., рп - парциальное давление компонентов, составляющих смесь газов.
Состав смеси газов может быть задан массовыми или объемными долями компонентов.
Массовой долей компонента, входящего в смесь, называется отношение массы этого компонента к массе всей смеси. Например, если смесь состоит из компонентов, имеющих соответственно массы Gu G2, G3,..., Gn, а масса всей смеси GCM, то массовая доля первого компонента G1 = G1/Gсм и т.д.
Очевидно, что масса смеси будет равна сумме масс компонентов смеси:
п
Gсм=G1+G2+ G3+ …+Gn= ∑ Gi [19]
l
Массовая доля любого компонента смеси выражается в долях единицы, поэтому сумма массовых долей
g1 + g2 + g3 +… + gn = ∑ gi = 1 [20]
Объемной долей компонента, входящего в смесь газов, называется отношение парциального объема компонента к объему всей смеси. Парциальным объемом компонента, входящего в смесь, называется объем компонента при давлении и температуре смеси.
Если обозначить парциальные объемы компонентов смеси через V1 V2, V3,..., Vn, объем всей смеси газов через Vс м а объемные доли компонентов через r1, r2, r3, rn то
r1 = V1/ Vс м r2 = V2/ Vс м rn= Vn/Vс м
Сумма парциальных объемов равна объему смеси (закон Амага):
Vс м = V1 + V2 + V3 +…+ Vn = ∑Vi [21]
Объемные доли компонентов, так же как и массовые, выражаются в долях единицы. Очевидно, что сумма объемных долей всех компонентов, составляющих смесь, должна равняться единице, т. е. в данном случае r1 + r2 + r3 + rn= ∑ri
Плотность смеси газов представляет собой массу 1 м3 смеси. Так как 1 м3 смеси состоит из суммы объемных долей каждого компонента, то очевидно, масса каждого компонента в 1 м3 смеси составит произведение его объемной доли на плотность. Тогда
ρсм = r1ρ1 + r2ρ2 + r3ρ3 + rnρn = ∑riρi
Удельный объем смеси можно определить по плотности смеси:
Vсм = 1/ρсм = 1/∑riρi
Для удобства решения практических задач со смесями газов введено понятие о кажущейся молекулярной массе смеси газов. Под последней понимается средняя масса из действительных молекулярных масс отдельных компонентов, составляющих смесь.
Кажущаяся молекулярная масса смеси газов может быть определена из уравнения
μсм = r1μ1+ r2μ2 + r3μ3 +…+rnμn= ∑riμi
Уравнение состояния смеси газов выводится на основании уравнений состояния отдельных компонентов смеси и имеет вид
pV = GRсмT, [22]
где Rсм— газовая постоянная смеси.
Для того чтобы можно было пользоваться уравнением (1.30), следуе1? определить величину газовой постоянной смеси Rcм
Если известны массовые доли отдельных компонентов смеси, то газовая постоянная ее может быть определена по уравнению
g1R1+g2R2+… +gnRn = ∑gi Rn [23]
Газовую постоянную смеси можно найти также по формуле
Rсм = 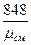 кГ.м/кг .град; или
кГ.м/кг .град; или 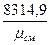 дж/кг .град.
дж/кг .град.
Например, для одной из самых распространенных смесей — для воздуха μсм =28,97, а следовательно, Rсм =29,27 кГ. м/кг . град или 287,1 дж/кг . град.
Дата добавления: 2014-12-24; просмотров: 2698;
