Гальванические элементы. Электродный потенциал металла
Согласно гидратационной теории гальванических элементов, при погружении металла в воду ионы его поверхностного слоя под действием полярных молекул воды отрываются, и в гидратированном состоянии переходят в раствор. В самом металле появляется избыток электронов, придающих ему отрицательный заряд.


В результате формирования двойного электрического слоя между металлом и окружающей его водной средой создается некоторая разность потенциалов, которую принято называть электродным потенциалом металла (φ0). По мере перехода ионов металла в водную среду увеличивается отрицательный заряд металла и положительный заряд раствора. Поэтому все чаще ионы металла притягиваются обратно на металлическую пластинку. Наступает равновесие:
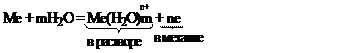
Возьмем два сосуда. В один из них, содержащий раствор сульфата цинка, опустим цинковый электрод, а в другой, содержащий раствор сульфата меди - медный электрод. Растворы соединим с помощью трубки, заполненной раствором электролита (насыщенным раствором KCl).
Металл, электродный потенциал (φ) которого более положительный, будет катодом. Металл, электродный потенциал (φ ) которого более отрицательный – анодом. На катоде всегда протекает процесс восстановления, а на аноде – окисление.
| электроды | Заряд во внешней цепи, φ | Процессы, протекающие на электродах |
| анод | Более отрицательный | окисление |
| а | о | о |
| катод | Болееположительный | восстановление |
| к | п | в |
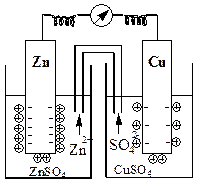
Гальванический элемент с применением соединительной трубки
Электродный потенциал цинка меньше электродного потенциала меди, поэтому в данном гальваническом элементе цинковый электрод будет анодом, а медный - катодом.
φ0 Zn2+/ Zn = - 0,76 В,
φ0 Cu2+/Cu =+0,34 В.
Такая схема означает, что цинковый электрод опущен в раствор его соли, а медный электрод – в раствор соли меди. Между растворами расположена пористая перегородка или соединительная трубка.
Причиной возникновения электрического тока в гальваническом элементе, т.е. причиной передвижения электронов по внешней цепи, является разность потенциалов взятых электродов
Гальванический элемент изображается электрохимической схемой:
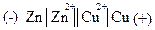
Одна черта обозначает поверхность раздела между электродом и раствором, две черты – пористую перегородку или соединительную трубку между растворами. Цинковый электрод, с которого поступают электроны, считается отрицательным, а медный – положительным. Названия электродам даются в соответствии с протекающими на них процессами. Анодом называется электрод, на котором протекает окислительный процесс. Катодом - электрод, на котором протекает восстановительный процесс.
Происходящие в гальваническом элементе процессы можно выразить электродными уравнениями:
Анод: Zn0-2e → Zn2+, окисление
в-ль
Катод: Cu2+ + 2e→ Cu0, восстановление
о-ль
Используя электродные потенциалы (φ), можно определить направление тока в гальваническом элементе и вычислить его электродвижущую силу (Е). При вычислении ЭДС гальванического элемента из потенциала катода вычитают потенциал анода.
Е0= φ0о-ль - φ0в-ль или Е0= φ0катода- φ0анода (в стандартных условиях);
Е= φо-ль - φв-ль или Е= φкатода- φанода (в реальных условиях).
Потенциал металла φ вычисляется по уравнению Нернста:
φ МеZ+/ Me = φ0 МеZ+/ Me+ RT/zF  ln[МеZ+] ;
ln[МеZ+] ;
где R – универсальная газовая постоянная;
T – температура по абсолютной шкале;
F – число Фарадея;
n – валентность металла (зарядность иона)
Преобразовав данное уравнение для стандартных условий, получают:
φ МеZ+/ Me = φ0 МеZ+/ Me + 0,059/z  lg [МеZ+] .
lg [МеZ+] .
Если Е>0, то электрохимический процесс вероятен, т.е. в гальваническом элементе будет протекать электрический ток.
Электролиз
Прохождение постоянного электрического тока через электролит
¾ +
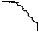
 Катод Анод
Катод Анод





 электролит
электролит
между катодом (К) и анодом (А) сопровождается протеканием на них электрохимических реакций, приводящих к появлению новых веществ. Такой процесс называют электролизом.
В промышленности электролиз проводят в электролизерах, которые включают в себя емкости с объемом до нескольких м3, и рабочие электроды (анод -подключается к положительному (+) и катод подключается к отрицательному (-) полюсам источника тока). Электроды электролизера могут быть различной формы, но это обязательно проводники 1-го рода-металлы, графит или другие твердые вещества с электронной проводимостью. Различают электролиз с растворимыми и нерастворимыми анодами.
При прохождении тока носителями зарядов в электродах являются электроны, а в электролите - катионы и анионы.
В электролизере анодный и катодный процессы пространственно разделены.
Если рассматриваемый электрод подключен к отрицательному полюсу источника тока, то на его поверхности протекают катодный процесс, при котором электроны передаются от электрода к частицам окислителя - процесс восстановления.
Реакция на катоде имеет вид
MeZ++ ne = Me0.
При этом другой электрод – анод подключен к положительному полюсу источника тока и на нём протекает реакция окисления.
Согласно закону Фарадея, масса выделенного вещества на каждом из электродов пропорциональна току и времени электролиза
М
m= ¾ Iτη
NF
где M- молекулярный (или атомный) вес выделенного вещества, n-число
электронов в суммарном уравнении электрохимической реакции, I – сила тока, А, τ- время,с, F – число Фарадея (96500 А*с), η – выход по току, % .
mпракт
 η = 100%
η = 100%
M
Электролизом раствора хлорида натрия (NaCl) в промышленности получают газообразный хлор и щелочь. На аноде протекает реакция окисления хлорид-ионов с образованием газообразного хлора
2Сl- - 2e = Cl2 - анодный процесс
а на катоде восстановление воды с образованием щелочи и выделением водорода
2H2О + 2e = Н2 + 2OH- - катодный процесс
| <== предыдущая лекция | | | следующая лекция ==> |
| Модели блокировок в базах данных | | | Внеклеточные организмы (вирусы и фаги). |
Дата добавления: 2019-07-26; просмотров: 1250;
