IX. Электродные потенциалы. Гальванические элементы.
Пример 1.Определите ЭДС концентрационного медного элемента с концентрациями ионов меди, равными 10–1 моль/л у одного электрода и 10–3 моль/л у другого при 298 К.
Решение. Схема такого гальванического элемента Cu½Cu2+||Cu2+½Cu. По уравнению Нернста рассчитываем потенциалы двух медных электродов.
Для первого электрода:
jСu2+/Cu = j0Сu2+/Cu + 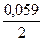 lg10-1 = 0,337 + 0,0295×(–1) = 0,3075 В
lg10-1 = 0,337 + 0,0295×(–1) = 0,3075 В
Для второго электрода:
jСu2+/Cu = j0Сu2+/Cu + 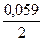 lg10-3 = 0,337 + 0,0295×(–3) = 0,2485 В
lg10-3 = 0,337 + 0,0295×(–3) = 0,2485 В
Первый электрод с большим значением потенциала в данном элементе является катодом, второй – анодом. ЭДС рассчитываем по формуле:
E = jк – jа = 0,3075 – 0,2485 = 0,059 В.
Пример 2. Рассчитайте ЭДС элемента Cd½Cd2+||Cu2+½Cu при концентрации ионов Cu2+ и Cd2+, равных соответственно 0,1 и 0,01 моль/л.
Решение. Используя уравнения Нернста и данные табл. 2, рассчитываем электродные потенциалы кадмия и меди:
jСu2+/Cu = j0Сu2+/Cu + 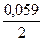 lg10-1 = 0,337 + 0,0295×(–1) = 0,3075 В
lg10-1 = 0,337 + 0,0295×(–1) = 0,3075 В
jСd2+/Cd = j0Сd2+/Cd + 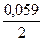 lg10-2 = –0,403 + 0,0295×(–2) = –0,462 В
lg10-2 = –0,403 + 0,0295×(–2) = –0,462 В
Так как jСd2+/Cd < jСu2+/Cu , то токообразующей в этом гальваническом элементе является реакция Cd0 + Cu2+ = Cd2+ + Cu0. Рассчитываем ЭДС элемента
E = jСu2+/Cu – jСd2+/Cd = 0,3075 – (–0,462 ) = 0,77 В.
Пример 3. Как изменится масса цинковой пластинки при взаимодействии ее с растворами: а) CuSO4; б) MgSO4; в) Pb(NO3)2? Почему? Составьте молекулярные и ионные уравнения соответствующих реакций.
Решение. В соответствии с положением ряду напряжений (табл. 2) ионы меди и свинца по отношению к цинку будут проявлять окислительную активность. При контакте с растворами CuSO4 и Pb(NO3)2 будут протекать реакции растворения цинка и осаждения соответствующего металла:
а) CuSO4 + Zn = Cu + ZnSO4; Cu2+ + Zn = Cu + Zn2+
б) Pb(NO3)2 + Zn = Pb + Zn(NO3)2; Pb2+ + Zn = Pb + Zn2+
Один моль эквивалентов цинка (32,69 г/моль) будет замещаться на один моль эквивалентов меди (31,77 г/моль) или свинца (103,6 г/моль). Учитывая молярные массы эквивалентов этих элементов, в растворе CuSO4 масса цинковой пластины будет незначительно уменьшаться, а в растворе Pb(NO3)2 – заметно увеличиваться.
Стандартный потенциал магния имеет меньшее значение, чем потенциал цинка (табл. 2). Это означает, что ионы магния не могут окислять цинковую пластинку. Поведение цинка в таком растворе аналогично окислению цинковой пластинки в воде: Zn – 2ē = Zn2+. Протекание такого процесса приведет к малозаметному снижению массы цинковой пластинки.
Пример 4. Исходя из значений стандартных электродных потенциалов и DG0х.р., укажите, можно ли в гальваническом элементе осуществить реакцию Pb2+ + Ti = Pb + Ti2+. Составьте схему гальванического элемента, напишите уравнения электродных реакций.
Решение. В соответствии с уравнением реакции схему гальванического элемента можно представить следующим образом: (–)Ti½Ti2+||Pb2+½Pb(+). Уравнения электродных реакций имеют вид:
на аноде: Ti0 – 2ē ® Ti2+
на катоде: Pb2++ 2ē ® Pb0
Рассчитываем стандартное значение ЭДС:
E 0 = j0к – j0а = j0Pb2+/Pb – j0Ti2+/Ti = –0,126 – (–1,628) = 1,502 B.
Энергию Гиббса рассчитываем по уравнению DG0 = – nE0F= – 2 ×1,502 ×96500 = –289,9 кДж. Так как DG0 < 0, токообразующая реакция возможна.
Дата добавления: 2017-02-20; просмотров: 1649;
