Массовый секундный расход газа
Массовый секундный расход газа может быть найден с помощью уравнения (2), в которое необходимо подставить площадь рассматриваемого поперечного сечения канала и соответствующие ему значения v и W.
Если 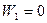 , то W подсчитывается по уравнению (14), а удельный объем выражается через его значение в сечении 1-1. Тогда для случая адиабатного течения получим
, то W подсчитывается по уравнению (14), а удельный объем выражается через его значение в сечении 1-1. Тогда для случая адиабатного течения получим
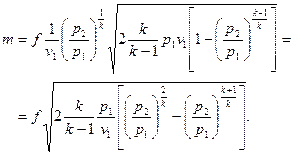 (15)
(15)
Анализ соплового течения газа через
Суживающееся сопло
Анализ уравнения (15) позволяет перейти к выводу о том, что при заданных 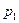 ,
, 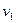 и
и 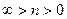 (область существования устойчивых равновесных состояний) величина массового секундного расхода зависит от значения выражения, взятого в квадратные скобки. Легко видеть, что при
(область существования устойчивых равновесных состояний) величина массового секундного расхода зависит от значения выражения, взятого в квадратные скобки. Легко видеть, что при 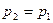 (рис. 2)
(рис. 2) 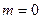 . При
. При 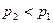 расход газа за счет увеличения расширения газа на участке 1-1 2-2 растет. Однако, при
расход газа за счет увеличения расширения газа на участке 1-1 2-2 растет. Однако, при 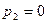
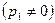 m снова становится равным нулю. Поскольку функция (15), будучи непрерывной, дважды проходит через ноль, то должен существовать максимум массового секундного расхода (рис. 3).
m снова становится равным нулю. Поскольку функция (15), будучи непрерывной, дважды проходит через ноль, то должен существовать максимум массового секундного расхода (рис. 3).

Величина соотношения 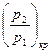 , отвечающая
, отвечающая 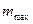 найдется, если взять первую производную от выражения в квадратных скобках уравнения (15) и приравнять ее нулю.
найдется, если взять первую производную от выражения в квадратных скобках уравнения (15) и приравнять ее нулю.
В результате получаем, что для адиабатного процесса изменения состояния критический перепад давлений равен
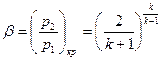 . (16)
. (16)
Естественно, что при подстановке в уравнение (15) вместо 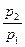 критического перепада давлений мы получим максимальную величину массового секундного расхода. Например, для адиабатного течения, которое чаще всего рассматривается в технических приложениях, имеем
критического перепада давлений мы получим максимальную величину массового секундного расхода. Например, для адиабатного течения, которое чаще всего рассматривается в технических приложениях, имеем
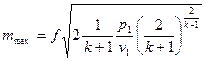 . (17)
. (17)
При дальнейшем уменьшении давления, в окружающей среде 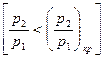 расход остается постоянным, равным
расход остается постоянным, равным 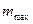 . Это явление получило название "кризис течения".
. Это явление получило название "кризис течения".
Скорость течения газа при 
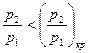 также остается постоянной. Эта скорость называется критической скоростью течения
также остается постоянной. Эта скорость называется критической скоростью течения 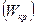 . Уравнение для определения
. Уравнение для определения 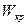 может быть получено, если в (14) вместо
может быть получено, если в (14) вместо 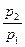 ввести критический перепад давлений
ввести критический перепад давлений 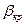
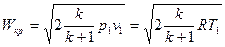 . (18)
. (18)
Разберем физическую картину процесса. По мере движения газа по каналу происходит его расширение, при котором уменьшается 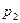 и
и 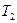 .
.
Снижение 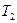 приводит к уменьшению местной скорости звука (9), а скорость потока возрастает. В выходном сечении канала скорость звука в соответствии с (9) будет равна
приводит к уменьшению местной скорости звука (9), а скорость потока возрастает. В выходном сечении канала скорость звука в соответствии с (9) будет равна
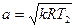 . (19)
. (19)
При кризисе течения скорость потока в выходном сечении определяется (18). Введем в это уравнение вместо 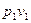 температуру Т. Для адиабатного процесса при
температуру Т. Для адиабатного процесса при 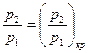
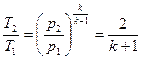
или
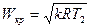 .
.
Таким образом, при достижении критического перепада давлений на выходе из суживающегося сопла скорость потока достигает местной скорости звука. Между тем, давление распространяется тоже со скоростью звука. В результате, уменьшение в окружающей среде давления ниже 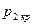 не может подойти к устью сопла, и в последнем устанавливается постоянное давление, равное
не может подойти к устью сопла, и в последнем устанавливается постоянное давление, равное 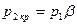 (19). Этим объясняется тот факт, что при
(19). Этим объясняется тот факт, что при 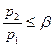
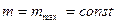
и
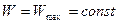 .
.
Сопло Лаваля
Проведенный анализ касался течения газа через суживающееся сопло. Из него не следует делать вывод о том, что вообще не возможно, например, при адиабатном течении получить скорость потока выше звуковой.
Как следует из уравнения (10.1), для перехода в область сверхзвуковых скоростей необходимо иметь расширяющийся канал. Следовательно, дополняя суживающийса канал, где газ достигает критической скорости, расширяющимся, мы предоставляем газу возможность продолжить свое расширение и приобрести сверхзвуковую скорость. Такое комбинированное сопло называется соплом Лаваля (рис. 4).
Сопло Лаваля целесообразно применять лишь при 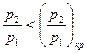 . Скорость истечения, например, при адиабатном течении определится с помощью уравнения (14). Расход определится по минимальному сечению, где имеет место кризис течения. Для этого используется уравнение для определения
. Скорость истечения, например, при адиабатном течении определится с помощью уравнения (14). Расход определится по минимальному сечению, где имеет место кризис течения. Для этого используется уравнение для определения 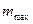 , в которое следует подставлять вместо f минимальное сечение сопла fmin.
, в которое следует подставлять вместо f минимальное сечение сопла fmin.
ЛЕКЦИЯ 7
РЕАЛЬНЫЕ ГАЗЫ
В ряде случаев приходится иметь дело с системами, состояние которых не позволяет использовать модель идеального газа. В качестве примера можно назвать водяной пар в тех состояниях, при которых он используется в паросиловых установках.
Здесь приходится принимать во внимание, что молекулы имеют определенные размеры и между ними существуют силы взаимодействия: притяжение при сравнительно больших расстояниях между молекулами и отталкивание при сближении молекул на малые расстояния.
Модель реального газа представляется в виде твердых шариков диаметром d0, взаимно притягивающихся друг к другу.
Как видно, модель реального газа отличается от модели идеального газа, во-первых, тем, что сами молекулы имеют некоторый объем, во-вторых, наличием сил межмолекулярного сцепления.
В общем случае, это приводит к тому, что в отличие от идеального газа
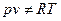
и при T = const
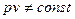 .
.
Устройство pv – диаграммы реального газа
Впервые подробное экспериментальное исследование зависимости p от v в разных изотермических процессах сжатия реального газа провел на углекислоте в 1857 – 1969 г.г. английский физик Эндрюс. Результаты его экспериментов показаны на рис. 1.
Как видно, при температурах, меньших 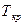 , изотермическое сжатие углекислоты (СО2) вначале сопровождается ростом давления. В точке а начинается процесс конденсации. Состояние, отвечающее этой точке, называют сухим насыщенным паром. При продолжении изотермического сжатия давление остается постоянным, а уменьшение объема сопровождается тем, что все большее количество пара превращается в жидкость.
, изотермическое сжатие углекислоты (СО2) вначале сопровождается ростом давления. В точке а начинается процесс конденсации. Состояние, отвечающее этой точке, называют сухим насыщенным паром. При продолжении изотермического сжатия давление остается постоянным, а уменьшение объема сопровождается тем, что все большее количество пара превращается в жидкость.
Наконец, в точке b конденсация завершается, и рабочее тело представляет собой кипящую жидкость. На участке ab одновременно существует и жидкая и газообразная фазы. Состояния, характеризуемые точками на ab, называют влажным насыщенным паром.
Соотношение между паровой и жидкой фазой характеризуют степенью сухости пара - это массовая доля сухого насыщенного пара во влажном. Степень сухости пара определяется выражением
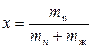 ,
,
где mn и mж – соответственно масса пара и жидкости во влажном насыщенном паре.
Удельный объем сухого насыщенного пара обозначают 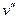 (точка а), а кипящей жидкости –
(точка а), а кипящей жидкости – 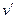 (точка b).
(точка b).

Рис. 1. PV – диаграмма реального газа
При продолжении изотермического сжатия в области v < v' отмечается резкое возрастание давления, так как жидкость обладает малой сжимаемостью.
С ростом температуры разность (v" - v'), быстро убывает за счет интенсивного уменьшения v" и некоторого роста v', т.е. с ростом температуры уменьшается разница между плотностями жидкой и газовой фаз.
Уменьшение (v" - v') продолжается вплоть до температуры Ткр, когда эта разность обращается в нуль (точка К), т.е. в этой точке исчезает различие между плотностями жидкости и пара. Точка К, отвечающая этому состоянию, называется критической точкой. Соответственно давление, температура и удельный объем называются критическими (ркр, Ткр, vкр). Естественно, что все попытки обеспечить путем изотермического сжатия сжижение газа при Т > Ткр, обречены на неудачу.
Критической температуре можно дать молекулярно-кинетическое толкование. Объединение свободнодвижущихся молекул в каплю, жидкости при сжижении газа происходит исключительно под действием сил взаимного притяжения. Этому препятствует кинетическая энергия движения молекул, равная с среднем kT (k – постоянная Больцмана). Очевидно, объединение молекул в каплю может произойти лишь при том условии, что кинетическая энергия движения молекул, пропорциональная Т, меньше или равна потенциальной энергии из взаимного притяжения (uo). Если кинетическая энергия больше потенциальной энергии взаимного притяжения, то конденсация жидкости при изотермическом сжатии не сможет произойти. Сопоставление этих положений с результатом анализа диаграммы Эндрюса позволяет сделать вывод о том, что Ткр – температура, соответствующая равенству указанных энергий
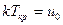 .
.
Если 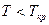 , то
, то 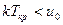 и конденсация при изотермическом сжатии возможна.
и конденсация при изотермическом сжатии возможна.
Если 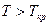 , то
, то 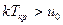 и конденсация при изотермическом сжатии не возможна.
и конденсация при изотермическом сжатии не возможна.
Дата добавления: 2019-04-03; просмотров: 1333;
