Сулардың химиялық ластануы
Су ластануы деп өзендерге, бұлақтарға, көлдерге, теңіздер мен мұхиттарға алуан түрлі физикалық ,химиялық немесе биологиялық заттардың түсуінің нәтижесінде су сапасының төмендеуін айтады.
Су ластануының себептері өте көп. Құрамында бейорганикалық және органикалық қалдықтар бар өнеркәсіптік ағызынды сулар, өзендер мен теңіздерге жиі құйылады. Жыл сайын ,су көздеріне мыңдаған химиялық заттар түседі .Олардың қоршаған ортаға түсетін әсері, көпшілік жағдайда алдын ала белгісіз. Бұл заттардың ішінде жүздеген жаңа қосылыстарда кездеседі. Өнеркәсіптік ағызынды сулар,көп жағдайларда алғашқы тазартудан өтсе де, олардың құрамында қиын анықталынатын улы заттар болады.
Тұрмыстық ағызынды сулардың құрамын да мысалы, синтетикалық жуғыш заттар болады. Ең соңында олар өзендер мен теңіздерге келіп түседі. Топырақ бетінен шайылып әкетілетін тыңайтқыштар,көлдер мен теңіздерге ағын сулармен құ йылады. Барлық осы аталған себептер, әсіресе тұйықталған бассейндердегі – көлдер, шығанақтар мен фиордтардағы (қойнаулардағы) судың қатты ластануын тудырады. Егер суда көп мөлшерде қалқымалы қатты заттар болса, онда олар суды бұлыңғыр етіп, күн сәулесінің өтуіне және фотосинтез процесінің жүруіне кедергі жасайды. Бұл, мұндай бассейіндердегі қорек тізбегінің бұзылуын тудырады. Сонымен қатар қатты қалдықтар болуынан, өзендер және кеме жүретін каналдар лайланады.
Қоректік заттар.Қоректік заттарға тірі организімдердің денсаулығы мен даму үшін өте қажет, бір қатар химиялық өнімдер жатады. Олардың кейбіреулері (мыс, темір, кобальт, маргенец) микроқоспалар түрінде тұтынылады, бірақ олардың тапшылығынан организімнің дамуы мен өсуі күрт бұзылуы мүмкін. Аса маңызды қоректік заттарға азот, фосфор, оттегі және күкірттің қатысуымен жүретін химиялық реакциялардың өнімдері жатады.


Көп жағдайларда элемент бүкіл биосфера арқылы (атмосфера, гидросфера және литосфераны қосқанда) өтіп, заттардың биохимиялық айналымына түседі. Басқа жағдайларда мысалы фосфор жағдайында, айналым кішілеу болады және қозғалыс әдетте атмосфера гидросферамен шектеледі. Бірақ барлық жағдайларда гидросфера осы айналымға кіреді.
Кейбір элементтер жалпыға тән элементтерге жатады, өйткені, олар барлық тірі организмдерге қажет. Бұл, мысалы, амин қышқылдарының синтезі жане азот немесе протиннің өндірілуі үшін керек фосфор мен күкірт. Басқа элементтер, жеке өзіне тән элементтер болып табылады, мысалы, мыс устрицалар үшін аса қажет,ал магний- хлорофилдің маңызды бөлігі. Жеке өзіне тән элементтерге, еңалдымен металдар жатады.Әр түрлі организмдер тек өздеріне ғана тән металдарды сіңіреді және концентрлейді.


Құрлық өсімдіктері сиақты гидросфера өсімдіктерінің (фитопланктонның) дамуын азот жане фосфор тыңайтқыштары түрінде енгізілген қосымша қоректік заттар жеделдетеді. Ең жеңіл сіңірілетін қоректік элементтер бұл нитратион NO3- гидрофосфат –ион HPO42-.Суда осы заттардың біреуінің немесе екеуінің артық концентрацияларының пайда болуынан фитопланктонның өсуі күшейеді,сондықтан басқа маңызды қоректік заттардың, ауыспалы металдар сияқтылардың,тұтынылуы қатар жүреді. Бұл жағдайда ең бірінші микроэлементтердің қоры таусылады. Олар нитраттар мен фосфаттар қоры сияқты сондай жеңілдікпен қайта қалпына келтірілмейді , сөйтіп бұл ауданның ең жоғарғы өсу жылдамдығын сақтап тұру қабілеті азаяды.


Басқа жағынан егер барлық қоректік заттар жеткілікті мөлшерлерде бар болса, онда өсімдіктерге балдырларға және гүлдің гүлденуіне қатысты, аса қатты зардаптар тудыратын жағдайлар орнайды. Балдырлардың (әсіресе көк –жасыл балдырлардың )өсіп жайылып кетуі әдәттегіге қарағанда судағы оттегінің көп мөлшерде сіңірілуін тудырады.Осының нәтижесінде мұндай судың ОБҚ-і артады. Сонымен қатар суға биологиялық қалдықтардың, мысалы ағаш целлюлозасының тасталуы немесе өңделмеген канализациялықсулардың құйылуы ОБҚ –нің жоғарлауына әкеледі. Қалған өсімдіктер мен тірі организмдер мұндай ортада өмір сүре алмайды. Бірақ мұнда өлі өсімдіктер мен жануарлар ұлпаларын ыдырататын микроорганизмдер күшті көбейеді. Бұл микроорганизмдер оттегіні оданда көп мөлшерде сіңіріп, нитраттар мен фосфаттарды көбірек түзеді.
Мұндай су қоймасында біртіндеп өсімдіктер мен жануарлар тұрлерінің саны елеулі азаяды. Бұл процесте еңауыр зардапқа ұшырайтын балықтар. Ақырында балықтардың өсіп жайылып кетуі мен өлі ұлпаларды ыдырататын микроорганизмдердің көбеюі нәтижесінде оттегінің концентрациясы азайып, көлдердің ескеруіне және батпақтануына әкеледі. Бұл процесті – эутрофикация деп атайды.
Эутрофикацияның классикалық мысалы ретінде АҚШ –тағы Эри көлін келтіруге болады. Бұл көлде 25 жыл ішінде азоттың мөлшері 50% - ке , ал фосфордікі -500% -ке жоғарылады. Оның ең басты себебі құрамында синтетикалық жуғыш заттар бар тұрмыстық ағызынды сулардың көлге құйылуы. Синтетикалық жуғыш заттардың құрамында фосфаттар көп болады.
Осы айтылған мәселелерге байланысты, екі жалпыға тән элементердің: азот және фосфордың, атқаратын ролі төменде толығырақ қарасмтырылады.
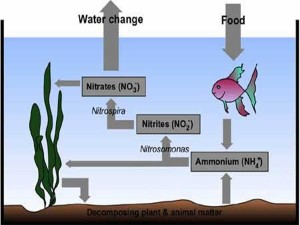
Азот.Азот гидросферада бірқатар бейорганикалық және органикалық қосылыстар түрінде кездеседі. Бейорганикалық қосылыстардың нитрат-иондары NO3- , нитрат NO2- және амоний NH4+ -иондары түрінде болады. Бейорганикалық және органикалық формалары мен тірі организмдер арасындағы азот алмасуы, оның мөлшерін анықтайтын негізгі фактор болып табылады.Азот алмасуы екі қарама –қарсы бағытталған процестер фотосинтез (органикалық қосылыстың құралуы) және органикалық заттардың ыдырауы кезінде жүреді.
Азоттың тұтынылуы тек оның биологиялық жүйеде бекітілуінен кейін ғана іске асады. Гидросферада мұндай жүйе ретінде көк –жасыл балдырлар бола алады. Бұл кезде амиак түзіледі:
N2 2N (бекітілуі) (1)
2N +3Р2 2NH3 (2)
Суда амиак аммони ионы NH4+ түрінде болып, екі сатылы нитрификация реакциясына ұшырайды. Бұл екі саты да тотығу реакцияларына жатады. Және автотрофты бактериалар қатысуымен сіке асады:
Nirosomonas
2NH3+3O 2H++2NO2- +2H2O (3)
Asotobacter
2NO2- +O2 2NO3- (4)
Схема түрінде реакцияны былайша көрсетуге болады:
NH3(немесе NH4+ ) → NO2- → NO3- (5)
Тотығу реакциаларының соңғы өнімі нитрат ион түрінде, яғни амин қышқылдары мен протеиндер түзілуі кезіндегі азот ассимиляциаланатын ( сіңірілетін) формасында болады.
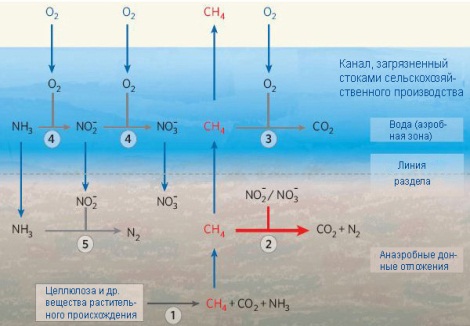
Өсімдіктер мен жануарлар өлгеннен соң, олардың белоктары ыдырайды. Бұл кезде бактериалардың басқа түрлері, амин қышқылдарының құрамындағы азотты аммонизация деп аталатын процестің нәтижесінде аммиакқа айналдырады:
H2N – (CH2)x –COOH → NH3+CO2 +H2O (6)
Түзілген аммиак, немесе аммоний – ионы циклге оралып, табтғатта тепе- теңдіктің қайта қалпына келуіне көмектеседі. Айналым айақталу үшін нитрат және нитрит иондар, бактериалардың көмегімен, денитрификация процесінің нәтижесінде газ күйдегі азотқа N2 не болмаса N2O айналады. Сонымен, қалыпты жағдайларда бекітілген азоттың толық мөлшері, қоршаған ортаға қайтып оралған азоттың толық мөлшеріне тең болады. Бұл процестердің барлығы, азоттың табиғатта айналымының құрам бөліктері болып табылады.
Бейорганикалық азоттың, биологиялық аймақта тұтынылатын формасына айналуында, әртүрлі бактериялардың, ең басты роль атқаратындығын көруге болады. Олар көпшілігінде, басқа организмдер тәрізді, қоршаған орта жағдайларының әсеріне ұшырайды, және бұл жағдайлардың бұзылуы бактериалардың активтілігінің өзгеруіне әкеледі.
Қазіргі кезде қоршаған орта үшін қауіп – қатер тудыратын әртүрлі жағдайлардың пайда болғаны айқын болып отыр. Нитрит – иондардың артық мөлшері, адам денсаулығы үшін қауіп тудырады және балдырлардың шамадан тыс өсуіне жағдай жасайды.
Ауыз суында нитраттардың өте көп мөлшерде болуы, асқазан рагы (сісігін) тудыруы мүмкін және балалар өлімінің көп болуы себебінің бірі деген ойлар айтылып жүр.
Алғашқы кездерде азотың айналымы біршама тұрақты болды, және азоттың қосылыстардың мөлшері денитрификация көмегімен, бүкіл бекітілген азот айналымға қайтып оралатындай еді. Бірақ тыңайтқыштар қолдануының өсуі салдарынан және азотты қалдықтар шығаратын өндіріс көлемінің ұлғаюы себептерінен бұрынғы тұрақтылық сақтамай отыр. Біртіндеп өсіп келе жаттқан ел тұрғындарының тастайтын, тегі органикалық қалдықтары да осы проблемаға өз үлесін қосады. Соның нәтижесінде динтрификацияға жауапты бактериалар, осы қарқыннан қалып қоя бастайды. Ақырында бір ауданда нитраттар мен нитриттердің жоғары концентрацияларына сәйкес зиянды зардаптары байқалуы мүмкін.
Бүкіл әлемде көлдер, шығанақтар мен жағалаудағы сулы жүйелер адамның шаруашылық әрекеттерінің және өнеркәсіптің азотты қалдықтарының көп мөлшері орналасатын негізгі орын болып саналады. Бұл қалдықтарының тасталуының әсері, әдетте қысқа мерзімді сипатты елерліктей проблемалар пайда болғанда ғана қарастырылады. Мысалы, сулы массаның эутрофикациясы немесе ауыз суының ластануы. Шындығында көптеген зерттеушілер,жағалау суларының эутрофикациясы азотты қоректік заттардың концентрациясымен анықталады деп есептейді. Бірақ ұзақ мерзмді сипатты азот айналымындағы өзгерістерден туатын эффектілердің маңыздылығы бұнан еш төмен емес, ал кейбір жағдайларда аса елеулі болады.
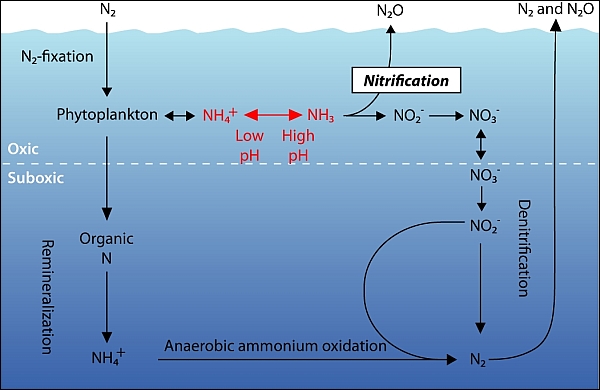
Егер бұрын қарастырылған реакциялардың жүйелігі бұзылса, онда мұның соңы, жойқын нәтижелер беруі мүмкін және оларды жұмсарту мүлдем қиын болады. Сондықтан сулы жүйеге көп мөлшерде азотты қалдықтарды тастауды шешуден бұрын көптеге процестердің - азот бекітілуінің, нитрификацияның және денитрфикацияның жылдамдықтары мұхиат бағалануы керек.
Ең жақсы жағдайда азотты қалдықтар азот айналымына топыраққа тыңайтқыштар түрінде қайта енгізілу керек, онда олар сулы жүйедегіге қарағанда тиімдірек пайдаға асуы мүмкін.
Фосфор. Сулы жүйеде азоттпен бірге фосфордың болуы қоректік заттардың негізгі қажеттілігін қанағаттандырады. Фосфордың айналымы, азоттікіне қарағанда қарапайымдау. Ол тек жер және сумен шектеледі, сондықтан оның циркуляциясы тау жыныстарындағы және тұнбалардағы (шөгіндірердегі ) фосфордың қорына тәуелді. Сулы жүйе оның жерден суға бағытталған біржақты қозғалысының соңғы орны болып табылады.
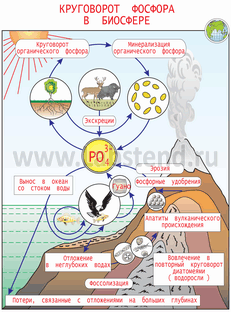

Гидросферада фосфордың айналымы азот айналымына айтарлықтай ұқсас,өйткені онда аса маңызды рольді, микробиологиялық прцестер атқарады. Бейорланикалық фосфат, алдымен биотада аденозинтрифосфат (АТФ,аденозиннің орта фосфаты) және аденозиндифосфат (АДФ, аденозиннің екіншілік қышқыл фосфаты ) формасына айналады. Ал олар әдетте бұл өзгерістердің нәтижесінде алынатын және организмдегі барлық биохимиялық процестердің энергетикалық мұқтаждығын қанағаттандыратын энергия көзі ретінде қарастырылады. Мысалы, протейн құрамында фосфор болмайды, бірақ ол фосфордың қатысуынсыз алынбайды. Шынында, егер сахарозаны фосфорилдеу қиындаса немесе тоқтап қалса, онда қажетті сахароза көміртек диоксидінен фотосинтез көмегімен алуы мүмкін. Бірақ оның кезекті реакциалары қатаң шешілген болады.
Сахароза қолданылуымен жүретін реакциалардағы фосфордың сіңірілуі мен қайта өңделуін жалпы схема түрінде былайша көрсетеді:
Глюкоза
АТФ Глюкоза фосфат + АДФ
Фруктоза
Бейорганикалық Бейорганикалық
фосфат фосфат + сахароза
Организмнің өмір сүру циклының соңында, фосфор бейорганикалық фосфат түрінде айналымды тұйықтау үшін және өзіне сәйкес жағдайларда биологиялық активтілігі қайтадан жеделдету үшін жүйеге қайтып оралады.
Гидросферада фосфордың табиғи формалары көміртек диоксиді сияқты рН-қа тәуелді.
Н3РО4 Н+ +Н2РО4 (8)
Н2РО4- Н+ +НРО42- (9)
НРО42 - Н+ +НРО42- (10)
Сулы жүйелерге тән рН мәндерінде НРО42- (шамамен 90%) формасы басым, онда Н2 РО4- (шамамен 10% ) қоспасы бар. Олардың біріншісі қоректік заттар үшін негізгісі болып саналады және әдетте біршама аз концентрацияларда болады. Айталық, мұхитта, нитрат –азот және фосфат –фосфор жүйелерінің салыстырмалы мөлшерлерінің қатынасы 15 : 1 тең.
Қазіргі кезде химиялық заттардың ( мысалы , детергентердің ) тасталуынан сулы жүйелерге фосфордың басқа да қосылыстары енеді (1 кесте). Көптеген детергенттердің компонентерінің бірі – конденсирленген фосфаттар, мысалы, триполифосфаттар:
О О О
|| || ||
НО– Р– О– О– Р– О– – Р– ОН
| | | |
ОН ОН х ОН
(мұндағы х == 1 және сутегі иондары натрий иондарымен алмасқан). Гидролиз кезінде олар конденцирленген фосфаттар формасына ауысады:
Р3О105- +2Н2О → 3НРО42- +Н+  (12)
(12)
Реакция жылдамдығы бірқатар локальды айнымалыларға тәуелді және әртүрлі жағдайларда өзгереді. Осы уақытқа дейін фосфаттың әртүрлі формаларының суда болу уақытын анықтау үшін жеткілікті мәліметтер жоқ.
Кез келген табиғи сулы жүйеде фосфордың бейорганикалық және органикалық формалары ертіндіде не болмаса қалқымалы күйде болады. Тұнбаға түсетін қосылыстардың құрамы көбінесе осыған дейін болған тұнбаның құрамына тәуелді. Мұндай жағдайларда биотада қолданылатын фосфордың формаларын және олардың сіңіруге қолайлы қосылыстарға айналу жылдамдығын анықтау керек.
Жоғарыда аталғандай, конденцирленген полифосфаттардың гидролизденіп, гидросферада, әсіресе, ағызынды суларда олар құйылғанға дейін фосфаттарға айналуының жылдамдығы сі жүзінде белгісіз. Сонымен бірге ерйтін бөлшектер түрінде, сол сияқты коллоидты формада да болатын әртүрлі бейорганикалық формалардың арасында алмасу жылдамдығы белгісіз. Мұның мәнісі фосфордың мөлшері мен оның келіп қосылу формасына байланысты мәселелер қазіргі уақытта шешілмей қалып отыруда.
Жоғарыда фосфордың қосылыстары гидросферада, су түбіне жақын тұнбаларда жиналып ,фосфордың миграциясы аяқталатындығы айтылды. Фосфорды жинаушы ретінде тұнбаның ролі тұнба үстіндегі су көлеміндегі фосфордың мөлшеріне біршама тәуелді. Шындығында, фосфор неғұрлым көп енгізілсе, соғұрлым ол аздау тұнбаға шөгеді және биологиялық циклде қайта өңдеуге едәуір жеңіл беріледі. Фосфаттар ертіндіде қалуға бейім болғандықтан, үлкен су массалары үшін ұзақ уақыт бойы эутрофикацияның белгілі аспектілері білінеді.
Бұрын фосфор айналымы құрлықтан суға және одан тұнбаға бағытталған бір жақты жүйе деп қарастырылады. Бірақ адамның қатысуның арқасында және фосфорлы қалдықтардың тасталуы күрт өсіп кеткендіктен, белгілі бір аудандарда тұнба қанығуы мүмкін. Сондықтан соңғы қабылдағыш су болады. Тыңайтқыштар өндірісі мен қолданылуы артқан сайын фосфор айналымы тездеп барады, сөйтіп көптеген сулы жүйелер осы қоректік затпен жылдам қанығатын болып отыр. Қазір әлі бұл процестің жалпы нәтйжесін бүкіл әлемдік маштабта көлре білу қиын, өйткені көптеген белгісіз факторлар бар. Бірақ фосфаттардың артық мөлшерінен туатын эутрофикация жағдайлары белгілі болғандықтан, түңілуге тұрарлық болжаулар айтуға болады.
| Топтар | Функционал топтың структурасы | Негізгі формалары | Қышқылдық константасы |
| Ортофосфаттар Полифосфаттар Метафосфаттар Органика- лық фосфаттар | О
||
-О– Р– О-
|
О-
О О
|| ||
-О – Р – О – Р–– О-
| |
О- О-
Пирофосфат
О О О
|| || ||
-О – Р–О–Р–О–Р–О-
| | |
О- О- О-
О О-
\\ ⁄ ⁄
Р
⁄ \
О О
| |
Р Р
⁄ \ ⁄ \
-О О О-
триметафосфат
ОН
|
СН2О–Р––ОН
||
О Н
ОН  ОН ОН
6-фосфат глюкоза ОН ОН
6-фосфат глюкоза
| Н3РО4, Н2РО4 НРО4,РО43- НРО4 комплекстер Н4Р2О7,Н3Р2О7, Н2Р О7 НР2О7,2Р2О74- НР2О7 комплекстер Н3Р3О102- Н2Р3О103- НР3О104- Р3О105- НР3О104- Комплекстер НР3О92-Р3О93- Құрамында фосфолипиттер,нуклеотидтер,фосфоамидтер,және тағы басқа қосылыстар бар түрлері | рКа.1==2,1 рКа.2=7,2 рКа.3=12,2 рКа.1==1,52 рКа.2=2,4 рКа.3=6,5 рКа4= 9,3 рКа.3==2,3 рКа.4=6,5 рКа.5=9,2 рКа.3==2,1 |
Металдар.Өнеркәсіптік ағызынды сулардың өзендер мен теңіздерге құйылуы, олардағы уытты ауыр металдардың, мысалы, кадмий сынап және қорғасынның, концентрацияларының жоғарылауына әкеледі. Олардың елеулі бөлігі, белгілі бір заттарға сіңіріледі немесе адсорбциаланады,сондықтан мұны кейде судың өздігінен тазарту процесі деп атайды. Бірақ тұйық бассейндерде, ауыр металдардың мөлшері қауіпті жоғары деңгейлерге жетуі мүмкін.
Осыған байланысты ең белгілі оқиға 1950 жылдарда Жапониядағы Минамата шығанағында болды. Бұл шығанаққа, құрамында сынаптың түрлі бейорганикалық және органикаолық қосылыстары ар өнеркәсіптік ағызынды сулар құйылады. Соның нәтижесінде, сынап қоректік тізбегіне ене бастады. Ол балдырларға сіңіріледі, ал олар молюскалар қоректенеді: молюскаларды балықтар жеді, ал балықтар - сол жердің тұрғындарының тағамына қолданады. Балықта сынаптың мөлшері сонша жоғары болғандықтан, бұл іштен кем туған балалардың пайда болуына және өлім жағдайларына әкеледі. Бұл ауру Минамата ауруы деп аталады.
Ауыр металдардың судағы конйентрациялары әдетте мил-1 аспайды, ал көп жағдайларда 10-10 моль/л дейін немесе одан да кіші микро және субмикроконцентрациялар аймағында болады. Осыған қарамастан, олар химиялық активтігінің арқасында сулы жүйелердің химиясында, басты роль атқарады.
Көбінесе өте аз мөлшерде болатын мыс, мырыш, кадмий және никель деген сияқты металдардың биологиялық жүйеде тіршілік үшін маңызы зор және олардың микроэлементтер ретінде қарастырылады. Бірақ жоғары концентрацияларда, осы металдар энзимдермен жүретін реакциялардың ингибиторы ретінде әсер етеді және кейбір жағдайларда белгілі бір организмдер үшін жоғары уыттылық көрсетеді.
 Металдардың биологиялық активтілігі мен химиялық реакцияға қабілеттілігі, жартылай олардың валенттік күйлеріне тәуелді. Металл иондарының аналитикалық конңентарциясы мен судағы организмдер үшін жетерлік концентрациясы арасында едәуір айырмашылық бар. Егер заттар кеуек өлшемі 0,45 мкм сүзгіштен өтсе, онда оларды нағыз ертінді деп қарастыруға болады. Мұндай сүзгіштен өтпей, оның бетінде қалатын заттар, дисперсті жүйелерге жатады. Заттарды осылайша бөлгенде, олардың химиялық құрлымын зерттеу екіші орынға қалады. Бірақ заттардың концентрациясы мен химиялық табиғаты жөніндегі мәліметтер, олардың қасиеттерін және сулы жүйеде жүреін реакцияларды түсіну үшін қажет. Металдар қосылыстарының құрлымы металдың тотығу дәрежесіне және оның комплекс түзуге қабілеттігіне байланысты.
Металдардың биологиялық активтілігі мен химиялық реакцияға қабілеттілігі, жартылай олардың валенттік күйлеріне тәуелді. Металл иондарының аналитикалық конңентарциясы мен судағы организмдер үшін жетерлік концентрациясы арасында едәуір айырмашылық бар. Егер заттар кеуек өлшемі 0,45 мкм сүзгіштен өтсе, онда оларды нағыз ертінді деп қарастыруға болады. Мұндай сүзгіштен өтпей, оның бетінде қалатын заттар, дисперсті жүйелерге жатады. Заттарды осылайша бөлгенде, олардың химиялық құрлымын зерттеу екіші орынға қалады. Бірақ заттардың концентрациясы мен химиялық табиғаты жөніндегі мәліметтер, олардың қасиеттерін және сулы жүйеде жүреін реакцияларды түсіну үшін қажет. Металдар қосылыстарының құрлымы металдың тотығу дәрежесіне және оның комплекс түзуге қабілеттігіне байланысты.
Ертіндіде түзілетін нақты химиялық қосылыстар, белгілі бір сулы жүйеде – химиялық, бологиялық және биологиялық құрлымдарды анықтауда қажет болады.Металдардың биологиялық активтілігі мен химиялық реакцияға түсу қабілеттілігі едәуір дәрежеде, металдар иондары ең алдымен әрекеттесетін табиғи сулы жүйедегі биорганикалық, сол сияқты органикалық қоспаларға байланысты. Ертіндіде, көптеген металдардың реакцияласу қабілеті жоғары. Металл ионының , комплексті қосылыстар түзуге қатысуы, оның басқа иондармен немесе молекулалармен әрекеттесу қабілетін бағалауға мүмкіндік береді.
Комплекісті ион бар немесе бірнеше молекулалар, не болмаса теріс зарядталған иондар орталық атомға қосылған молекула, немесе теріс зарядты ион- лигандтар деп аталады. Әдетте олар орталық атомға кординациялық байланыстың нәтижесінде қосылады. Сондықтан түзілген қосылыстар кординациялық қосылыстар, ал орталық атомға қосылған лиганнттар саны, координациялық сан деп аталады. Схемадағы стрелкалармен координациллық, немесе доннырлы –акцепторлы байланыстар, символ түрінде өрнектелген. Қарапайым лигандтар, мысалы Н2О,NH3,CN- және СL- монодентатты – лигандтар деп аталады, өйткені олардың әрқайсысы, тек қана бір координациялық байланыс түзе алады. Бидентатты лигандтар орталық атоммен екі координациялық байланыс түзеді. Үш кординациялық байланыс түзетін лигандтар, тридентатты деп аталады.
Сулы ертіндіде комплекісті иондардың химиялық қасиеттері металдық координациялық сферасындағы бір лиганнтың басқа лигантпен ығыстырылуы қабілетіне тәуелді.Мысалы, гексаамминокобальт (II) ионы, кобальт (ІІ) ионының координациялық сферасында судың алты молекуласының орнын, алты аммиак молекуласы басқанда түзіледі. Мұны келесі теңдеумен көрсетуге болады:
Со(Н2О)6+2(аq)+6NH3(aq)  ↔ [ Co(NH3)6]2+(aq)+6H2O (13)
↔ [ Co(NH3)6]2+(aq)+6H2O (13)
Комплексті Со(Н2О)62+ -ионында, су молекулалары, лигандтар болып табылады. Мұндай лигандтар саны алтау болғандықтан, кобальттың координациялық саны 6 тең. Бұл ион кобальттың (ІІ) гидратталған ионы немесе гексааквакобальт (ІІ) ионы деп аталады.
Қарапайымдылық үшін жоғарыда келтірілген теңдеуді әдетте былайша жазады:
Со2+(аq) + 6NH3(aq)↔ [Co (NH3)6]2+(aq) (14)
Сулы ертіндідегі кобальт (ІІ) ионын жазу үшін Со2+ символы жазылғанда, бұл осы ионның гидратталған күйде болатындығын көрсетеді.
Комплекстердің түзілуін ескеріп, тепе – теңдік жағдайларын қарастырудың жалпы әдісін диаграмма түрінде көрсетуге болады:
K1
M+L ↔ML (15)
K2
ML+L ↔ML2 (16)
K3
ML+L ↔ML3 (17)
MLn-1+L ↔MLn (18)
мұнда М- металл ионы, ал L- монодентатты лиганд.
Комплексті МLnионының түзілуін сипаттайтын тепе –теңдік константасы мына өрнекпен анықталады:
Ктұр= 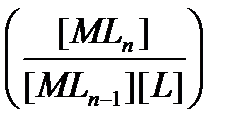 тепе теңдік (19)
тепе теңдік (19)
Бұл шаманы, тұрақтылық константасы, немесе түзілу константасы деп атайды. Комплексті ионның тұрақтылық константасы (Ктұр) оның тұрақтылығының көрсеткіші болады. Неғұрлым бұл константа көп болған сайын, соғұрлым комплекстің тұрақтылығы көп. Кейбір комплекстердің Ктұр мәндері аса үлкен. Мысалы, 
Fe(H2O)63+(aq)+6N-(aq_)↔[Fe(CN)6]4-(aq)+6H2O(1) (20)
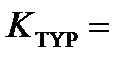

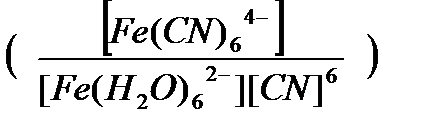 тепе-теңдік (21)
тепе-теңдік (21)


Бұл тұрақтылық константасының сандық мәні 298К –де 1037 (моль/дм3)-6 тең. Ктұр өлшемі (моль/дм3)-n , мұнда n - орталық атомының координациялық саны. Мұндай үлкен сандық шама, гексациано – феррат (ІІ) комплекстің түзілуі аяғына дейін толық жүретіндігін көрсетеді. Комплексті иондардың тепе –теңдік концентрацияларын келтіргенде, олардың формуласында қолданылатын тік жақшаларды әдетте алып тастайды. Мысалы, [Fe(H2O)62+
Fe(H2O)62+ деп жазады. Тік жақшаларды бұл жағдайларда концентрацияны көрсету ұшін пайдаланады.
Сулы жүйелерде кездесетін кәдімгі лигандтарға Н2О,OH- CN- Cl-SO42- HCO3- және бірқатар органикалық қосылыстар молекулалары жатады.
Оқытудың техникалық құралдары:интерактивті тақта, проекторсызба – кестелер, видео-, дыбыс аппаратурасы.
Оқытудың әдістері мен түрлері:баяндау, сұрақ – жауап, түсіндіру, кіріспе лекция
Деңгейлік тапсырмалар:
1деңгей. Комплекстердің түзілуін ескеріп, тепе – теңдік жағдайларын қарастырудың жалпы әдісін диаграмма түрінде көрсетуге болатынын жазыңыз.
2-деңгей. Гидросферадағы фосфордың айналымын түсіндіріңіз.
3-деңгей. Сулы жүйелерде кездесетін кәдімгі лигандтарды жазып көрсетіңіз.
ОБСӨЖ тапсырмалары:Химиялық ластағыш заттардың биосфераға және оның компоненттеріне әсері.
СӨЖ тапсырмалары:Гидросферада химиялық ластағыш заттардың таралуының жалпы заңдылықтары.
Пайдаланылатын әдебиеттер:
1. Жұмаділлаева С., Баешов А., Жарменов А. Қоршаған орта химиясы. – Алматы, 1998.
2. Джумадуллаева С., Баешов А., Жарменов А., Мамырбекова А. Практикум по химии окружающей среды. Учебник. – Алматы, 2000.
3. Голдовская Л.Ф. «Химия окружающей среды ».М.: Мир, 2005.
4. Зилов Е.А. Химия окружающей среды.-Иркутск, 2006.
Дата добавления: 2017-03-29; просмотров: 551;
