СТРОЕНИЕ МНОГОЭЛЕКТРОННЫХ АТОМОВ И ИОНОВ
Электрон в атоме существует в виде электронного облака, то есть определенной области околоядерного пространства, которая охватывает примерно 90 % заряда и массы электрона. Эта область пространства называется орбиталь. Для полной характеристики состояния каждого электрона в атоме необходимо указать для него значения четырех квантовых чисел: главного n, орбитального l, магнитного ml и спинового ms.
Главное квантовое число характеризует основной запас энергии электрона и размер электронного облака. Оно может принимать только положительные целочисленные значения от 1 до ¥. Чем больше значение n, тем больше размер электронного облака. Совокупность электронных состояний, имеющих одинаковое значение n, называется электронным слоем или энергетическим уровнем. К энергетическим уровням приняты следующие буквенные обозначения
| Главное квантовое число | |||||
| Уровень | K | L | M | N | O |
При n = 1 энергия электрона имеет минимальное значение Е1 = -13,6 эВ. Такое состояние электрона называется основным или нормальным. Состояния с n = 2, 3, 4… называются возбужденными. Энергии, соответствующие им, связаны с Е1 выражением
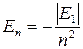 (4)
(4)
При переходе электрона с одного энергетического уровня на другой поглощается или испускается квант электромагнитной энергии DЕ
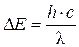 (5)
(5)
где с – скорость света (с = 3×108 м/с); с/l = n – частота излучения, с-1.
Орбитальное (иначе побочное или азимутальное) квантовое число определяет момент количества движения электрона и характеризует форму электронного облака. Может принимать все целочисленные значения от 0 до (n - 1). Каждому значению l соответствует своя форма электронного облака: при l = 0 – сферическая; l = 1 – гантелевидная; l = 2 – две пересекающиеся под прямым углом гантели.
Электроны одного энергетического уровня, имеющие одинаковые значения l, образуют энергетические подуровни, которые имеют следующие буквенные обозначения
| Орбитальное квантовое число | |||||
| Подуровень | s | p | d | f | g |
Значения энергий в подуровнях каждого уровня несколько различаются. Число подуровней, на которые расщепляется энергетический уровень, равно номеру уровня, то есть значению n.
Состояние электрона, соответствующее определенным значениям n и l, записывается в виде сочетания цифрового значения n и буквенного l (например, при n = 3 и l = 1 записывают 3p).
Магнитное квантовое число характеризует пространственную ориентацию электронного облака, принимает все целочисленные значения от – l до + l, всего в каждом подуровне (2l + 1) значений. Число значений, принимаемых ml, указывает число возможных положений электронного облака данного типа в пространстве, то есть число орбиталей в подуровне. Так, любой s-подуровень состоит из одной орбитали, p-подуровень – из 3, d-подуровень – из 5, а f-подуровень – из 7. Все орбитали одного уровня обладают одинаковой энергией и называются вырожденными.
Состояние электрона в атоме, охарактеризованное значениями квантовых чисел n, l и ml, называется атомной орбиталью (АО).
Спиновое квантовое число характеризует собственный механический момент электрона, связанный с вращением его вокруг своей оси. Оно может принимать только два значения ms = +1/2 и ms = – 1/2.
При распределении электронов в атоме по АО соблюдается несколько принципов и правил. Согласно принципу минимальной энергии электроны в атоме стремятся занять в первую очередь те АО, которым соответствует наименьшее значение энергии электрона. Реализация этого принципа осуществляется на основе правила Клечковского:
с ростом атомного номера элемента электроны размещаются на АО последовательно по мере возрастания суммы (n + l); при одинаковых значениях этой суммы раньше заполняется орбиталь с меньшим значением числа n.
Согласно правилу Клечковского заполнение энергетических уровней в основном соответствует следующему ряду: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p и т.д.
Вырожденные орбитали одного уровня заполняются электронами в соответствии с правилом Хунда (Гунда):
в пределах энергетического подуровня электроны располагаются так, чтобы их суммарный спин был максимальным.
Это означает, что сначала электроны заполняют все свободные орбитали подуровня по одному, имея при этом одинаково направленные спины, и только потом происходит заполнение этих АО вторыми (парными) электронами. В соответствии с принципом Паули на одной АО может находиться не более двух электронов, отличающихся друг от друга значением ms. Таким образом, максимальная электронная емкость любого s-подуровня равна двум, p-подуровня – шести, d-подуровня – 10 е, а f-подуровня – 14 е.
Общее число АО на энергетическом уровне определяется по формуле
NАО = n2 (6)
Общее число электронов на уровне можно вычислить по уравнению
Nе = 2n2 (7)
При отрыве одного или нескольких электронов от атома он превращается в положительно заряженный ион – катион, заряд которого равен числу отнятых электронов. Присоединение одного или нескольких электронов к атому приводит к образованию отрицательного иона – аниона, отрицательный заряд которого равен количеству принятых электронов.
При образовании катиона в первую очередь атом покидают электроны внешнего энергетического уровня, так как в этом случае энергетические затраты на отрыв электрона будут минимальными. При образовании аниона электроны размещаются на уровнях в соответствии с принципом минимума энергии.
Валентными называют электроны, которые располагаются на внешнем энергетическом уровне и отдельных подуровнях второго (для лантаноидов и актиноидов – третьего) от конца электронного слоя, которые не сформированы полностью, то есть количество электронов в подуровне не достигло предельного значения.
Элементы, в атомах которых происходит заполнение s-орбиталей, относятся к семейству s-элементов; в которых заполняется p-подуровень, относятся к семейству p-элементов и т.д.
Пример 1. Квантовые числа валентных электронов иона Э2- равны
Номер электрона n l ml ms
1 3 0 0 + 1/2
2 3 0 0 - 1/2
3 3 1 -1 + 1/2
Определите порядковый номер элемента и назовите его.
Р е ш е н и е
Валентная электронная формула иона Э2-: …3s23p1. После удаления двух лишних электронов электронная конфигурация атома примет вид Э:…3s1. Добавим недостающие электроны Э:1s22s22p63s1. Общее количество электронов (2 + 2 + 6 + 1) = 11, значит это элемент № 11 – натрий Na.
Пример 2.Запишите полную электронную формулу элемента с порядковым номером 27. Отметьте его валентные электроны и укажите для них значения всех квантовых чисел. К какому электронному семейству относится данный атом? Запишите электронную формулу валентных подуровней данного атома после удаления двух валентных электронов.
Р е ш е н и е
Элемент с № 27 – кобальт Со. Составляем его электронную формулу
27Со: 1s22s22p63s23p64s23d7
Валентными электронами являются электроны 4s и 3d подуровней. Значения квантовых чисел для каждого из девяти валентных электронов равны
Номер электрона n l ml ms
1 4 0 0 + 1/2
2 4 0 0 - 1/2
3 3 2 -2 + 1/2
4 3 2 -1 + 1/2
5 3 2 0 + 1/2
6 3 2 1 + 1/2
7 3 2 2 + 1/2
8 3 2 -2 - 1/2
9 3 2 -1 - 1/2
Поскольку заполняется подуровень d, то кобальт относится к семейству d-элементов.
При отрыве от атома кобальта двух электронов образуется ион Со2+. Электронная формула валентных электронов Со2+: …4d75s0.
Пример 3. Запишите электронные формулы атома кремния в нормальном и возбужденном состояниях.
Р е ш е н и е
Электронная формула атома кремния содержит 14 электронов. В нормальном состоянии Si14: 1s22s22p63s23p2. При возбуждении один из парных электронов 3s-орбитали переместится на подуровень 3p и электронная формула примет вид
Si + E ® Si*: 1s22s22p63s13p3.
Дальнейшее возбуждение атома кремния невозможно, так как все валентные электроны атома являются непарными.
З а д а ч и
1. Атом какого элемента в основном состоянии имеет электронную конфигурацию 1s22s22p63s2? Определите общее число энергетических уровней и подуровней, занимаемых электронами в данном атоме.
2. Пользуясь правилом Гунда, распределите электроны по орбиталям, отвечающим низшему энергетическому состоянию атомов: марганца, азота, кремния.
3. Сколько свободных f-орбиталей содержится в атомах элементов с порядковыми номерами 59, 60, 90, 93? Пользуясь правилом Гунда, распределите электроны по орбиталям для атомов этих элементов.
4. Напишите электронные формулы еще не открытых элементов №110 и №113 и укажите, какое место они займут в периодической системе.
5. Атом элемента имеет электронную формулу 1s22s22р63s23р6. Напишите для него электронные формулы иона Э- и условного иона Э7+.
6. Напишите электронные формулы атомов элементов с порядковыми номерами 21 и 23. Сколько свободных d-орбиталей в атомах этих элементов? Укажите валентные электроны элементов.
7. Запишите электронные формулы атомов и ионов: Se, Ti2+, V3-. Отметьте их валентные электроны.
8. Напишите электронную формулу атома и назовите элемент, если значения квантовых чисел валентных электронов равны:
| Номер | Главное | Побочное | Магнитное | Спиновое |
| +1/2 | ||||
| - 1/2 | ||||
| -1 | +1/2 |
9. У элементов каких периодов электроны внешнего слоя характеризуются значением суммы (n + l) = 5? К каким электронным семействам относятся эти элементы?
10. Запишите электронные формулы частиц: Br-, Br+, Br5+. Запишите квантовые числа валентных электронов иона Br+.
11. Определите число непарных электронов в атоме иридия. Укажите значения квантовых чисел валентных электронов данного атома.
12. Запишите электронную формулу атома серы, сколько непарных электронов имеет этот атом в нормальном и возбужденном состояниях? Каковы электронные формулы S2- и S4+?
13. Сколько и какие пространственные ориентации d-орбиталей Вы знаете? Каким квантовым числом это определяется?
14. Запишите полные электронные формулы атомов и ионов: Zn4-, Kr, Se2+. Отметьте их валентные электроны.
15. Определите порядковый номер элемента и запишите полную электронную формулу атома, если после присоединения к нему двух электронов квантовые числа валентных подуровней таковы:
| Номер | Главное | Побочное | Магнитное | Спиновое |
| +1/2 | ||||
| -1/2 | ||||
| +1/2 | ||||
| -1 | +1/2 | |||
| -2 | +1/2 |
16. Напишите электронные формулы частиц: Po, Bi3+, Mn2-. Изобразите электронно-графические схемы их валентных подуровней.
17. Запишите полную электронную формулу и электронно-графическую схему валентных подуровней атомов таллия и криптона.
18. Определите общее число электронов не 8 энергетическом уровне.
19. Сколько свободных d-орбиталей имеется в атомах титана и ванадия? Запишите для этих атомов значения квантовых чисел внешнего слоя.
20. Сколько значений магнитного квантового числа возможно для электронов энергетического подуровня, орбитальное квантовое число которого: а) l = 3; б) l = 4?
21. Какой элемент имеет в атоме три электрона, для каждого из которых n = 3 и l = 1? Чему равны для них значения магнитного квантового числа? Имеет ли данный атом парные электроны?
22. Составьте электронные формулы элементов с порядковыми номерами 27 и 60. Укажите значения всех квантовых чисел для валентных электронов ионов этих элементов с зарядами + 1 и – 1.
23. Могут ли существовать конфигурации р7 или d12- электронов. Почему? Составьте электронную формулу атома элемента с порядковым номером 22 и укажите его валентные электроны.
24. Напишите электронные формулы атомов элементов с порядковыми номерами 15 и 28. Чему равен максимальный спин р-электронов у атомов первого и d-электронов у атомов второго элемента.
25. Атом какого элемента имеет следующее строение наружного и предпоследнего электронных слоев 2s22р63s23р1? Запишите для них полные электронные формулы в возбужденном состоянии.
26. Атом какого элемента имеет следующее строение наружного и предпоследнего электронных слоев 3s23р63d34s2? Запишите для них квантовых чисел валентных электронов в нормальном состоянии.
27. Атом какого элемента имеет следующее строение наружного и предпоследнего электронных слоев 3s23р63d104s24р5? Запишите для них квантовых чисел валентных электронов в возбужденном состоянии.
28. Атом какого элемента имеет следующее строение наружного и предпоследнего электронных слоев 4s24р64d75s1? Запишите для них полные электронные формулы в возбужденном состоянии.
29. Атом какого элемента имеет следующее строение наружного и предпоследнего электронных слоев 4s24р64d105s0? Запишите для них полные электронные формулы в возбужденном состоянии.
30. Сколько свободных d-орбиталей имеется в атомах ниобия и циркония? Запишите для этих атомов значения квантовых чисел внешнего слоя.
Дата добавления: 2018-11-25; просмотров: 1119;
