СВОЙСТВА АТОМОВ И ИОНОВ
Химическая активность элемента определяется способностью его атомов терять или приобретать электроны.
Энергия, необходимая для удаления 1 моль электронов от 1 моль атомов какого либо элемента, называется первой энергией ионизации I1. Отрыву второго, третьего и т. д. электронов соответствует вторая I2, третья I3 и т. д. энергии ионизации, причем, I1 < I2 < I3. Особенно резкое увеличение энергии ионизации наблюдается при отрыве электронов из заполненного уровня. Энергию ионизации измеряют в кДж/моль или в электрон-вольтах (1 эВ = 1,6×10-19 Дж).
Наименьшее напряжение электрического поля, при котором происходит отрыв электрона, называется потенциалом ионизации. Численное значение энергии ионизации в эВ равно потенциалу ионизации в вольтах.
Энергия ионизации характеризует восстановительную способность элемента. Чем меньше значение I1, тем более сильным восстановителем является атом.
В периодах с увеличением порядкового номера элемента первая энергия ионизации возрастает, однако, на электронных конфигурациях, заканчивающихся полностью или наполовину сформированными подуровнями, проявляются локальные максимумы значений I1. Это связано с тем фактом, что такие электронные конфигурации обладают повышенной энергетической устойчивостью (их сложнее разрушить). Например, во втором периоде при переходе от N7: 1s22s22p3 к О8:1s22s22p4 порядковый номер увеличивается, а первая энергия ионизации уменьшается от 14,53 эВ у азота до 13,61 эВ у кислорода. В общем случае локальные максимумы значений I1 следует ожидать у атомов, чья электронная формула заканчивается …ns2, …np3, …np6, …(n – 1)d5, …(n – 1)d10 и т.д.
В подгруппах с увеличением порядкового номера элемента I несколько снижается, что обусловлено увеличением размеров атомов и расстояния внешних оболочек от ядра.
Таким образом, восстановительная способность элементов в группе сверху вниз возрастает, а в периодах слева направо уменьшается.
Окислительная способность атома характеризуется величиной сродства к электрону F – энергией, которая выделяется при присоединении 1 моль электронов к 1 моль атомов. Чем больше значение F, тем сильнее выражены окислительные свойства атома. В группах с увеличением порядкового номера элемента энергия сродства к электрону уменьшается, а в периодах – возрастает, но не монотонно. Локальные максимумы значений F смещены на один элемент влево по сравнению с энергией ионизации атома. Таким образом, наибольшими значениями F обладают элементы VII группы главной подгруппы. У большинства металлов и у благородных газов сродство к электрону невелико или отрицательно.
Для характеристики способности атомов притягивать к себе электроны, введено понятие - электроотрицательность (ЭО). Эта величина имеет условный характер, так как способность атома притягивать электроны зависит от типа соединения и валентного состояния элемента.
По шкале Р. Малликена
ЭО = 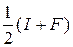 , эВ (8)
, эВ (8)
Использование шкалы Малликена затруднено, так как отсутствуют надежные методы определения сродства к электрону.
Более широкое использование получила относительная шкала электроотрицательностей Л. Полинга. По этой шкале абсолютная ЭО атома лития принята равной единице, а ЭО остальных атомов отнесены к значению абсолютной ЭО(Li). Максимальное значение относительной ЭО, которое равно 4, имеет атом фтора (ЭО(F) = 4). В периодах с ростом порядкового номера элемента электроотрицательность возрастает, а в группах, как правило, убывает.
Поскольку движение электрона имеет волновой характер, невозможно установить абсолютные размеры атомов. В химической практике наиболее часто пользуются двумя типами радиусов: орбитальным радиусом и эффективным радиусом.
Под орбитальным радиусом понимают теоретически рассчитанное расстояние от ядра до главного максимума электронной плотности внешней орбитали. В периодах по мере роста заряда ядра орбитальные радиусы атомов уменьшаются, а в группах – увеличиваются, причем в главных подгруппах увеличение происходит в большей мере, чем в побочных.
Эффективные радиусы атомов рассчитывают из экспериментальных данных, как половину расстояния между центрами смежных атомов в кристалле. Такие радиусы затруднительно сравнивать между собой, так как на их значение оказывают влияние различные факторы (структура вещества, характер связи, степень окисления элемента и т.д.).
При образовании катиона орбитальный радиус частицы уменьшается по сравнению с размером атома, причем, чем больше заряд катиона, тем меньше радиус. В случае образования аниона орбитальный радиус частицы возрастает тем больше, чем выше отрицательный заряд иона.
Пример 1. Укажите, как изменяются первая энергия ионизации, сродство к электрону и орбитальный радиус в ряду элементов K – Cu – Rb. Какой из перечисленных элементов является более сильным окислителем?
Р е ш е н и е
Калий и медь стоят в одном периоде, поэтому при переходе от K к Cu энергия ионизации и сродство к электрону возрастают, а орбитальный радиус уменьшается.
Калий и рубидий находятся в одной подгруппе, следовательно, при переходе от K к Rb энергия ионизации и сродство к электрону уменьшаются, а орбитальный радиус возрастает.
Пример 2. Определите относительную ЭО атома хлора, если I(Cl) = 1140,8 кДж/моль, F(Cl) = 3,54 эВ, а абсолютная ЭО атома лития составляет 2,55 эВ.
Р е ш е н и е
Найдем абсолютную ЭО атома хлора по формуле (8). Для этого значение энергии ионизации пересчитаем с кДж/моль на эВ по формуле
I(Cl) = 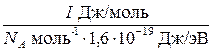 ,
,
где NA – постоянная Авогадро.
I(Cl) = 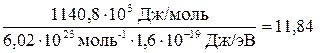 эВ.
эВ.
Тогда абсолютная ЭО(Cl) = 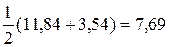 эВ.
эВ.
Для определения относительной ЭО хлора поделим абсолютное значение ЭО(Cl) на абсолютное значение ЭО(Li)
ЭО(Cl) = 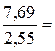 3,01.
3,01.
Пример 3. Сравните энергии ионизации у следующих пар атомов: а) …2s22p3 и …2s22p4; б) …3s2 и …2s22p2. Ответ мотивируйте.
Р е ш е н и е
а) Элементы …2s22p3 и …2s22p4 располагаются в периодической системе в одном периоде, так как их валентные электроны имеют одинаковые значения главного квантового числа (n = 2). Кроме того, данные элементы стоят в периоде друг за другом (их электронные конфигурации отличаются на один электрон). В периоде с ростом порядкового номера энергия ионизации увеличивается. Однако, I(…2s22p3) > I(…2s22p4), поскольку у электронной конфигурации …2s22p3 имеется наполовину заполненный p-подуровень, то есть здесь наблюдается локальный максимум энергии ионизации;
б) Элементы …3s2 и …2s22p2 расположены в разных периодах и группах, поэтому их нельзя сравнивать без привлечения вспомогательного элемента. Таким элементом может служить …2s2, так как с первым он стоит в одной группе (число валентных электронов одинаково и равно 2), а со вторым – в одном периоде. Тогда I(…2s2) > I(…3s2), потому что с увеличением порядкового номера в группе происходит уменьшение энергии ионизации, а I(…2s22p2) > I(…2s2), поскольку в периоде энергия ионизации увеличивается. Таким образом, I(…2s22p2) > I(…2s2) > I(…3s2) или иначе I(…2s22p2) > I(…3s2).
З а д а ч и
1. Значение первых потенциалов ионизации элементов I группы периодической системы элементов соответственно равны (В): Li -5,4; Cs - 3,9; Cu - 7,7; Ag - 9,2. Укажите: а) у элементов какой подгруппы I группы металлические свойства выражены более резко; б) чем объяснить различный ход изменения значений потенциалов ионизации в подгруппах.
2. Рассчитайте энергию ионизации алюминия (кДж/моль), соответствующую отрыву третьего электрона, если потенциал ионизации алюминия равен 28,44 В.
3. Вычислите относительную электроотрицательность углерода, если первый ионизационный потенциал углерода равен 11,26 В, а его сродство к электрону 1,12 эВ.
4. Исходя из величин потенциалов ионизации, докажите какой из приведенных элементов Li, Na, K, Rb, Cs является более сильным восстановителем.
5. Какой из s-элементов подгруппы II-A является более сильным восстановителем по отношению к хлору? Ответ мотивируйте.
6. Относительная электроотрицательность йода равна 2,5 а его ионизационный потенциал 10,45 В. Определите сродство йода к электрону (кДж/моль).
7. Сравните энергии ионизации у следующих пар атомов: бор и углерод, кремний и фосфор, кальций и цинк.
8. Определите электроотрицательность атома лития в кДж/моль, если ЭО атома фтора равна 10,2 эВ, а относительные ЭО атомов лития и фтора соответственно равны 1 и 4.
9. Для какого из двух атомов энергия ионизации больше: …6s26p3 или …6s26p4? Ответ объясните.
10. Для какого из двух элементов энергия ионизации меньше: …3p64s1 или …3s23p6? Ответ мотивируйте.
11. Сравните значения атомных радиусов элементов: Ca и Zn, Ca и Sr. Ответ объясните.
12. Для атома алюминия значения последовательных энергий ионизации составляют (эВ): I1 = 6,0; I2 = 18,8; I3 = 28,4; I4 = 120,0. Объясните, чем вызван резкий скачок при переходе от I3 к I4.
13. Сравните энергии ионизации и электроотрицательности у следующих пар атомов: а) …4d45s1 и …4d65s1; б) …5s25p3 и …5s25p4. Ответ объясните.
14. Сравните радиусы частиц: Mg2+, Ca2+, Ba2+. Ответ объясните.
15. Укажите, как изменяется энергия ионизации и атомный радиус при переходе от серы к фосфору.
16. Для какого из атомов энергия ионизации больше и почему: …4d45s2 или …4d55s2?
17. Для какого из элементов энергия ионизации больше: … 3s23p64s1 или …3s23p64s2? Ответ объясните. Сравните значения энергии сродства к электрону для этих элементов.
18. Сравните атомные радиусы элементов: галлия и иттрия; фосфора и ванадия. Ответ объясните.
19. Сравните энергию сродства к электрону у атомов третьего периода. Ответ объясните.
20. Для какой электронной конфигурации радиус атома больше: …6s26p4 или …6s26p5? Ответ мотивируйте.
21. Объясните ход изменения значения энергии ионизации у элементов:
| Элемент | Кальций | Барий | Цинк | Ртуть |
| I1, эВ | 6,1 | 5,8 | 9,4 | 10,4 |
22. Исходя из величин потенциалов ионизации, докажите какой из приведенных элементов Be, Ca, Mg, Sr, Ba является более сильным восстановителем.
23. Сравните атомные радиусы элементов: скандия и иттрия; фосфора и серы. Ответ объясните.
24. Для какой электронной конфигурации радиус атома меньше: …5s25p5 или …6s26p5? Ответ мотивируйте.
25. Сравните радиусы атомов и значения электроотрицательностей у следующих пар атомов: а) стронций и кадмий; б) гафний и тантал. Ответ объясните.
26. Укажите, как изменяется энергия ионизации и атомный радиус при переходе от мышьяка к селену и почему.
27. Расположите в порядке уменьшения энергии сродства к электрону элементы: Ca, Mg, Zn. Ответ объясните.
28. Исходя из величин потенциалов ионизации, докажите какой из приведенных элементов Р, Na или Ti является более сильным восстановителем.
29. Для какой электронной конфигурации радиус атома больше: …3s23p6 или …3s23p5? Ответ мотивируйте.
30. Укажите, как изменяется энергия ионизации и атомный радиус при переходе от брома к селену и почему.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА
По мере роста заряда ядра происходит закономерная периодическая повторяемость электронных структур валентных подуровней элементов, и как следствие, повторяемость их свойств. Современная формулировка периодического закона гласит:
свойства химических элементов, а также формы и свойства образуемых ими соединений находятся в периодической зависимости от величины заряда ядер их атомов.
Графическим изображением периодического закона является таблица периодической системы элементов Д.И. Менделеева, в которой элементы располагаются в порядке возрастания заряда ядер их атомов и подразделяются на естественные совокупности – периоды и группы.
Период представляет собой горизонтальный ряд элементов, в атомах которых происходит заполнение одинакового числа электронных слоев. Номер периода совпадает со значением главного квантового числа внешнего энергетического уровня и показывает общее число электронных оболочек атома. Каждый период (исключая первый) начинается типичным металлом и заканчивается благородным газом, которому предшествует неметалл. Таким образом, в периоде с увеличением заряда ядра атомов свойства элементов постепенно изменяются от металлических к типично неметаллическим, что связано с увеличением числа электронов на внешнем энергетическом уровне.
Первые три периода содержат только s- и p-элементы и называются малыми. Четвертый и последующие периоды кроме s- и p-элементов содержат также d- и f-элементы и называются большими. У атомов s- и p-элементов свойства соседних атомов изменяются отчетливо, поскольку у них идет формирование электронами внешнего слоя. Для d- и в особенности для f-элементов одного и того же периода отличия в свойствах проявляется менее четко, так как у них происходит заполнение электронами внутренних энергетических уровней, тогда как конфигурация внешнего слоя практически не изменятся.
Элементы периодической системы подразделяют на восемь групп. Положение элемента в группе определяется общим числом его валентных электронов. Каждая группа состоит из главной и побочной подгрупп. В главных подгруппах находятся только s- и p-элементы, побочные подгруппы содержат d-элементы. В соответствии с особенностями электронных структур f-элементов их относят к III побочной подгруппе. В коротком (восьмиклеточном) варианте периодической системы Д.И. Менделеева 4f-элементы шестого периода и 5f-элементы седьмого периода вынесены за рамки таблицы как семейства лантаноидов и актиноидов соответственно.
Элементы-аналоги, то есть элементы, расположенные в одной подгруппе, имеют одинаковое строение внешнего энергетического уровня при разных значениях главного квантового числа n и поэтому проявляют сходные химические свойства. В подгруппах с увеличением порядкового номера происходит усиление металлических свойств элементов и ослабление неметаллических свойств.
Пример 1. Дайте общую характеристику элемента с порядковым номером 33. Укажите его основные химические свойства.
Р е ш е н и е
Это элемент As – мышьяк. Его полная электронная формула
33As: 1s22s22p63s23p63d104s24p3
Находится в 4-ом периоде (n = 4 - застраивается четвертый энергетический уровень), в V группе главной подгруппы (имеет 5 валентных электронов …4s24p3, которые располагаются на внешнем слое). Мышьяк относится к семейству p-элементов.
Наличие пяти электронов на внешнем слое атома указывает на то, что мышьяк – неметалл. Однако он также обладает слабо выраженными металлическими свойствами, поскольку в группе сверху вниз происходит ослабление неметаллических свойств.
Высшая степень окисления мышьяка +5, так как он имеет пять валентных электронов. Низшая степень окисления равна –3, так как до электронного октета ему недостает трех электронов.
Пример 2. Объясните, почему селен и хром, находясь в одном и том же периоде и в одной группе, обладают разными свойствами.
Р е ш е н и е
Селен и хром – это элементы шестого периода VI группы. Селен относится к семейству p-элементов и находится в главной подгруппе, тогда как хром – d-элемент, стоящий в побочной подгруппе.
Атом селена имеет на внешнем слое шесть электронов (…4s24p4), а атом хрома – один электрон (….3d54s1). Следовательно, у селена сильнее выражены неметаллические свойства, а у хрома – металлические.
Литература
1. Общая химия в формулах, определениях, схемах / И.Е. Шиманович, М.Л. Павлович, В.Ф. Тикавый, П.М. Малашко; Под ред. В.Ф. Тикавого. Мн.: Унiверсiтэцкае, 1996.
2. Ахметов Н.С. Общая и неорганическая химия. Учеб. для вузов. М.: Высш. шк., 1998.
3. Гольбрайх З.Е., Маслов Е.И. Сборник задач и упражнений по химии. М.: Высш. шк., 1997.
4. Лидин Р.А., Молочко В.А., Андреева Л.Л. Задачи по неорганической химии. М.: Высш. шк., 1990.
5. Романцева Л.М., Лещинская З.Л., Суханова В.А. Сборник задач и упражнений по общей химии. М.: Высш. шк., 1991.
6. Коршунов Б.Г., Стефанюк С.Л. и др. Задачник по общей химии для металлургов. М.: Высш. шк., 1977.
7. Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов – М.: Интеграл-Пресс, 2001.
8. Задачи и упражнения по общей химии: Учеб. пособие/ Б.И. Адамсон, О.Н. Гончарук, В.Н. Камышова и др.; Под ред. Н.В. Коровина. –М.: Высш. шк., 2003.
Дата добавления: 2018-11-25; просмотров: 1827;
