Свойства фосфора и его соединений
Фосфор - составная часть растительных и животных белков. У растений фосфор сосредоточен в семенах, у животных - в нервной ткани, мышцах, скелете. Организм человека содержит около 1,5 кг фосфора: 1,4 кг - в костях, 130 г - в мышцах и 13 г в нервной ткани. В природе фосфор находится в связанном виде. Важнейшие минералы: апатит Ca5(PO4)3F и фосфорит Ca3(PO4)2. Фосфор может быть получен нагреванием смеси фосфорита, угля и песка в специальной печи:
Ca3(PO4)2 + 5C + 3SiO2 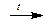 2P + 3CaSiO3 + 5CO
2P + 3CaSiO3 + 5CO
Фосфор образует несколько аллотропных модификаций: белый, красный и черный фосфор. Наиболее активен белый фосфор, молекулярная кристаллическая решетка которого построена из тетраэдрических молекул Р4. Фосфор используется при производстве фосфорорганических пестицидов (тиофоса, карбофоса, хлорофоса и др.). Красный фосфор, имеющий атомную решетку, используется в спичечном производстве.
Фосфор в степени окисления -3 образует водородное соединение фосфин PH3, аналогичное аммиаку. Эта степень окисления менее характерна для фосфора, чем для азота. Фосфин - ядовитый газ с чесночным запахом, может быть получен из фосфида цинка действием кислот или воды:
Zn3P2 + 6HCl ® 2PH3 + 3ZnCl2
Основные свойства фосфина слабее, чем у аммиака:
PH3 + HCl ® PH4Cl
Соли фосфония в водных растворах неустойчивы:
PH4+ + H2O ® PH3 + H3O+
Фосфин имеет восстановительные свойства (низшая степень окисления фосфора), горит на воздухе:
2PH3 + 4O2 ® P2O5 + 3H2O
Фосфид цинка используется в качестве зооцида для борьбы с грызунами.
Оксид фосфора(III) P2O3 (или Р4О6) образуется при окислении фосфора в недостатке кислорода и представляет собой белое кристаллическое вещество, плавящееся при 23,8оС. Этот кислотный оксид взаимодействует с водой, образуя фосфористую кислоту:
Р2О3 + 3Н2О ® Н3РО3
Фосфористая кислота в водных растворах существует в виде двух равновесных таутомерных формах:



 Н¾O O H¾O
Н¾O O H¾O



 P
P  H¾O P
H¾O P
H¾O H H¾O
Под действием щелочей равновесие сдвигается влево, при действии спиртов ROH - вправо. Поэтому фосфористая кислота является слабой двухосновной кислотой, образующей при действии щелочей, например NaOH, кислую соль NaH2PO3 и среднюю соль NaHPO3.
Трех замещенные фосфиты не известны.
Оксид фосфора(V) P2O5 (или P4O10) образуется при горении фосфора на воздухе.
4Р + 5О2 ® 2Р2О5
Твердое кристаллическое вещество Р2О5 гигроскопично и используется как водо-отнимающее средство. При взаимодействии с водой оксид фосфора(V) образует на холоду метафосфорную кислоту НРО3, имеющую полимерное строение, или при нагревании ортофосфорную кислоту Н3РО4.
P2O5 + H2O ® 2HPO3
P2O5 + 3H2O 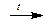 2H3PO4
2H3PO4
Осадок метафосфата серебра AgPO3 - белого цвета, осадок ортофосфата серебра Ag3PO4 - желтого цвета. В промышленности фосфорную кислоту получают действием серной кислоты на фосфорит:
Ca3(PO4)2 + 3H2SO4 ® 3CaSO4 + 2H3PO4
Ортофосфорная кислота представляет собой кристаллическое вещество (tпл = 42оС), растворимое в воде. Как трехосновная кислота средней силы диссоциирует ступенчато. Различают средние соли - фосфаты (Na3PO4) и кислые соли - гидрофосфаты (Na2HPO4) и дигидрофосфаты (NaH2PO4). Растворимы в воде фосфаты и гидрофосфаты щелочных металлов и аммония. Все дигидрофосфаты растворимы в воде.
Многие фосфаты используются в качестве удобрений: фосфоритная мука Ca3(PO4)2 и преципитат CaHPO4 (на кислых почвах), суперфосфат Ca(H2PO4)2´2CaSO4, двойной суперфосфат Ca(H2PO4)2.
Дата добавления: 2018-11-25; просмотров: 416;
