Свойства углерода и его соединений
Оксид углерода(II) СО является безразличным оксидом, также, как и SiO, NO, N2O. Его можно получить:
CO2 + ® 2CO или 2С + О2 ® 2СО
СО - сильный восстановитель:
3СO + Fe2O3 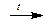 2Fe + 3CO2
2Fe + 3CO2
CO + CuO 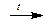 Cu + CO2
Cu + CO2
CO - угарный газ - ядовит, реагирует с гемоглобином, образую карбоксигемоглобин.
Оксид углерода(IV) CO2 - углекислый газ - взаимодействует с водой, образуя слабую, неустойчивую угольную кислоту H2CO3:
CO2 + H2O  H2CO3
H2CO3  H+ + HCO3-
H+ + HCO3-  2H+ + CO32-
2H+ + CO32-
CO2 взаимодействует с основаниями, образуя карбонаты и гидрокарбонаты:
CO2 + Ca(OH)2 ® CaCO3¯ + H2O
+ CaCO3¯ + H2O ® Ca(HCO3)2
В промышленности CO2 получают при обжиге известняка CaCO3, получая негашеную известь СаО, при температуре более 950оС:
CaCO3 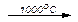 CO2 + CaO
CO2 + CaO
В лаборатории CO2 получают в аппарате Киппа, действуя на мрамор соляной кислотой:
CaCO3 + 2HCl ® CaCl2 + H2O + CO2
Образующийся при этом СО2 очищают от примесей HCl и паров воды, пропуская через раствор гидрокарбоната натрия и концентрированную серную кислоту:
HCl + NaHCO3 ® NaCl + H2O + CO2
H2O + H2SO4(конц.) ® H2SO4×H2O
СО2 не горит и не поддерживает горение, его используют для тушения пожара. CaCO3 используют для известкования сильнокислых почв.
В соединениях с металлами углерод проявляет отрицательные степени окисления: Al4+3C3-4, Ca+2C2-1 и др. Ацетиленид (“карбид”) кальция CaC2 получают при высокой температуре сплавлением оксида кальция с углем. При взаимодействии с водой CaC2 образует ацетилен.
СаО + 3С 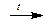 CaC2 + СО
CaC2 + СО
CaC2 + 2H2O ® Ca(OH)2 + C2H4
Дата добавления: 2018-11-25; просмотров: 317;
