Идеальные растворы из двух летучих компонентов.
|
|
|
Общее давление пара над раствором р будет равно сумме парциальных давлений его компонентов; для раствора, содержащего компоненты А и В, общее давление р=рА+рВ.
На основании уравнения (*), как для компонента А, так и для компонента В, можно считать 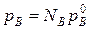 , а NА=1-NВ.
, а NА=1-NВ.
Общее давление будет равно:
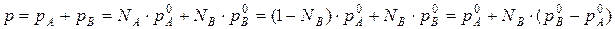
(3) (***)
Это уравнение характеризует линейную зависимость давления от мольной доли компонента В, что можно отобразить графически.
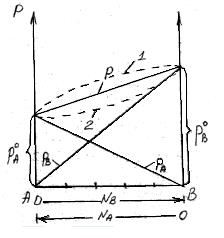
На рисунке по оси ординат слева отложены парциальные давления компонента А, которые изменяются от 0 до рA0, а справа – изменения парциального давления компонента В. Общее давление р изменяется от рA0 до рВ0. Линейная зависимость общего и парциальных давлений от состава раствора характерна для идеальных и разбавленных растворов (ΔV=0; ΔH=0; ΔS=ΔSи.г).
Практически, идеальными свойствами обладает раствор бензола в толуоле, что объясняется незначительностью сия межмолекулярного взаимодействия между молекулами всех компонентов раствора. Поэтому общее давление над раствором бензола в толуоле равно сумме парциальных давлений каждого из компонентов.
В случае предельно разбавленных растворов, концентрация растворенного вещества в которых бесконечно мала, давление пара (газа) растворителя выражается в соответствии с законом Рауля:
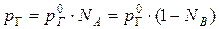
Давление паров растворенного вещества, которого в предельно разбавленном растворе ничтожно мало, не подчиняется закону Рауля. В этом случае давление пара над раствором описывается законом Генри, который формулируется так: при постоянной температуре парциальное давление растворенного вещества рГ пропорционально его мольной доле:
 ,
,
где КГ – коэффициент пропорциональности, называемый константой Генри (справочная величина), которая зависит от температуры и природы компонентов раствора, но не зависит от давления.
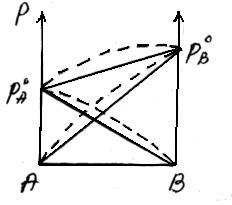
Для неидеальных растворов линейная зависимость общего давления от состава раствора нарушается: наблюдается положительное и отрицательное отклонения. Причем, как правило, эти отклонения одного знака как для общего давления р, так и для парциальных давлений рA и рВ компонентов раствора.
Положительное отклонениеот закона Раулянаблюдается в том случае, когда в растворе идет диссоциация молекул компонентов в растворе. Такие растворы образуются с поглощением теплоты (ΔH>0), т.е. процесс растворения будет эндотермическим.
ΔH>0, fA-A > fA-В
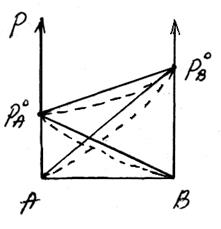
Отрицательное отклонениеот закона Раулянаблюдается в случае ассоциации (укрупнения) частиц, формирующих раствор, и образования более прочных связей. При этом растворение идет с выделением теплоты (ΔH<0), т.е. процесс экзотермический.
ΔH<0, fA-A < fA-В
Дата добавления: 2017-09-19; просмотров: 659;
