Изменения белков в технологическом потоке
Нативная трехмерная структура белков поддерживается разнообразием внутри- и межмолекулярных сил и поперечных связей. Любое изменение условий среды в технологических потоках производства пищевых продуктов оказывает влияние на связи молекулярной структуры и может привести к разрушению четвертичной, третичной и вторичной структуры. Этот процесс называется денатурацией.
Большинство белков денатурируются в присутствии сильных минеральных кислот или оснований, при нагревании, охлаждении, обработке поверхностно-активными веществами, мочевиной, солями тяжелых металлов (Ag, Pb, Hg) или органическими растворителями (этанолом, метанолом, ацетоном).
Большая часть белков денатурируется при температурах выше 60°С, однако встречаются и термостабильные белки (казеин и а-лактоальбулин молока и а-амилазы некоторых бактерий). Тепловая денатурация белков является одним из основных физико-химических процессов, лежащих в основе выпечки хлебобулочных изделий, сушки макаронных изделий, варки, жарения овощей, рыбы, мяса, консервирования, пастеризации и стерилизации молока. Данный вид превращений относится к полезным, так как он ускоряет переваривание белков в желудочно-кишечном тракте человека.
Однако при тепловой обработке продуктов выше 100°С со значительной скоростью протекает взаимодействие белков с восстанавливающими сахарами, сопровождающееся образованием карбонильных соединений и темноокрашенных продуктов – меланоидинов, при этом теряются незаменимые аминокислоты (лизин, треонин), что ухудшает пищевую ценность продукта.
Термическая обработка белоксодержащей пищи при температурах выше 120°С или при более низких, но в щелочной среде, приводит не к денатурации, а к разрушению (деструкции) макромолекул белка с отщеплением функциональных групп, расщеплением пептидных связей и образованием сероводорода, аммиака, углекислого газа и ряда более сложных соединений небелковой природы. Некоторые из них обладают мутогенными свойствами.
Наряду с денатурацией белков возможна их агрегация. Способность белков к формированию высоко агрегированных и надмолекулярных образований зависит от рН, ионной силы и состава среды.
С повышением рН от 4,0 до 9,1 агрегация белков злаковых культур (пшеницы, ржи, ячменя) повышается. Также агрегирующая способность белков повышается при увеличении концентрации нейтральных солей.
Дегидратация белков.Потеря белками связанной воды происходит под влиянием внешних воздействий: сушка продуктов питания, замораживание, хранение в замороженном состоянии и размораживание пищевых продуктов.
Коллоидное состояние белка.Белки обладают различной растворимостью. Одни белки растворяются в дистиллированной воде, другие – в слабых солевых растворах, третьи – в спирте. Некоторые белки нерастворимы.
Часто растворение белков в воде начинается с набухания. При этом белки поглощают воду и увеличиваются в массе в 1,5 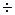 2 раза.
2 раза.
Способность белка набухать зависит от многих факторов: рН раствора, введения солей, температуры и др. Минимальное набухание происходит в изоэлектрической точке и усиливается при сдвиге рН в кислую или щелочную сторону от изоэлектрической точки.
Растворение не всегда сопровождается набуханием, оно характерно для фибриллярных белков (глобулярные белки молока набухают незначительно). При растворении белков образуются коллоидные растворы золи (с диаметром частиц 0,001-0,1 мкм).
Дата добавления: 2017-02-20; просмотров: 765;
