Лекция. 3 Основные показатели химико-технологических процессов
============================================================
Состав, концентрация вещества
· Мольная масса – масса 1 моль вещества, кг (M)
· Мольный объем – объем 1 моль вещества, м куб. (V)
Способы выражения концентраций компонентов в смеси:
· Мольная доля : число молей вещества А / общее число молей;
· Массовая доля: масса вещества А / общая масса смеси;
· Объемная доля: объем вещества А / общий объем смеси.
Массовые, объемные, мольные соотношения компонентов смеси- (например, 1:2:3)
· Массовая концентрация: кг/м3 ;
· Объемная концентрация: м3 / м3 ;
· Мольная концентрация: кмоль / м3 ;
Характеристики газовых смесей:
· Нормальные условия (н.у.): Т=273 К; P=0,1 МПа (0,103 Мпа );
· Объем, занимаемый 1 кмоль газа при н.у. =22,4 м куб.
· Зависимости, между давлением (Р), объемом (V) и температурой (Т):
(уравнение Менделеева) для n моль газа: Р×V = n×R×T
· Универсальная газовая постоянная: R = 8,314 кДж/моль×К;
(если Р=кгс / м кв. – R =848 кгс / кмоль×град.)
Для двух различных состояний газа: Р×V = Р²×V², или Р×V/Т = Р²×V²/ Т²
· Давление газовой смеси: Р = р1 + р²+...+ рi ;
· Объем газовой смеси: Y = y1 +y²+...+ yi ;
· Средняя мольная масса смеси: x.М. + х²М² + ... + хi Мi;
· Cредняя плотность газа: r = Мср./22,4, кг/м.куб;
· Относительная плотность газа по воздуху при н.у.: b = r. / 1,293;
· Критическая температура (Ткр.) – температура, при которой плотность жидкости и насыщенных ее паров одинаковы.
· Критическое давление (Ркр.) – давление насыщенного пара при Ткр.
(при Т>Ткр. Состояние вещества газообразное)
· Критический объем (Vкр.) – объем, занимаемый веществом в критическом состоянии (наибольший объем в жидком состоянии).
· Вязкость газов и жидкостей, Па×с (1 Па×с = 10 пуаз).
· Вязкость смеси газов: m = 1 / > х, / м, ;
· Зависимость вязкости газов от температуры ( формула Сатерленда):
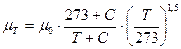 , Па×с .
, Па×с .
Показатели стадий химического превращения:
Конверсия (К) – степень превращения, т.е. отношение количества вещества, вступившего в реакцию (прореагировавшего вещества) к количеству этого вещества, подаваемого в реакционный аппарат.
Выход целевого продукта, (%):
· на пропущенное сырье – количество полученного целевого продукта отнесенного к количеству сырья, загруженного в реактор;
· на разложенное сырье – то же, отнесенное к количеству сырья, вступившего в реакцию.
Селективность– количество полученного целевого продукта, отнесенное к максимально возможному теоретическому, % (для процессов протекающих в несколько стадий учитывают селективность на каждой стадии).
Расходные коэффициенты – количество сырья или его компонентов, а также вспомогательных материалов, пара, электроэнергии, холода и т.д. израсходованного на производство 1 т продукции.
Производительность– количество целевого продукта, получаемого в единицу времени (кг/с, т/год и т.д.).
Мощность производства – максимально возможная производительность при оптимальных условиях процесса.
Интенсивность процесса– производительность, отнесенная к единице полезного объема аппарата.
Объем реакционной зоны: Vр = Vс × t,
где Vс – объемный расход, м куб/с, t - время контакта, с;
Объемная скорость – объем газовой смеси или жидкости, проходящей через единицу объема катализатора за единицу времени:
V об. = Vсырья / V кат.
Производительность катализатора – масса целевого продукта, снимаемого с единицы объема или массы катализатора:
П = G прод. /Vкат, кг/м куб.; П = G прод. /Мкат, кг/кг.
Время пребывания реагирующих веществ в реакционной зонедляреакций1 порядка: t = (2,303/К)×(а/а-х);
2 порядка: t = (2,303/К² )×[в×(а-х)] / [а×(в-х)] ;
3 порядка: t = (1/К)×[(1/а-х)-1/а];
где: К – константы скорости, соответственно: 1-1/c; 2 - л/моль×с; 3 – л /моль ×с;
а и в – начальные мольные концентрации веществ, моль/л;
х- концентрации вещество вступивших в реакцию к моменту времени t, моль/л.
Скорость гомогенного процесса: V=K×C;
гетерогенного процесса: V=K×F×C,
где: К – константа скорости, С – движущая сила, F – поверхность соприкосновения фаз.
Движущая сила: необратимой реакции (типа аА +вВ=дД):
С=(Са - С²а)×(Св - С²в),
где: Са и Св – текущие концентрации; С² и С²в – равновесные концентрации, рассчитанные на основании степени превращения.
Зависимость константы скорости реакции от температуры:
-Е/RТ
К=К0  ×е - уравнение Аррениуса.
×е - уравнение Аррениуса.
Если известна КТ1, то: КТ2 = КТ1×е Е / [ R (1 / T – 1 / T ²) ]
Материальный баланс:SМ приход. =SМ расход.+ М потерь;
Тепловой баланс:SQ приход. =SQрасход.+ Q потерь;
Для процессов без фазовых превращений при массовом расходе вещества:
Q = М×С×t (C=кДж/кгײС); при мольном расходе: Q = n×c×T C=кДж/кмоль×К);
Для химической реакции: Q = - DH;
Тепловой эффект при стандартных условиях (Закон Гесса):
Н²298 = S Н²298 прод. - S Н²298 исх.
Изменение теплового эффекта реакции в зависимости от температуры:
Н²Т2 = Н²Т1 + Ср×Т (закон Кирхгофа);
Зависимость Ср от Т: Ср = Dа + DвТ + DсТ2 + Dс²/Т2 ;
Тема 2. ПРОИЗВОДСТВО ПАРАФИНОВ
=============================================================
Дата добавления: 2017-08-01; просмотров: 315;
