Определение теплоты сгорания и образования ЭМ (ВВ) по Карашу
При отсутствии справочных данных теплоты образования ВВ могут быть вычислены по расчетной теплоте сгорания. Расчет теплоты сгорания по методу Караша основан на современных представлениях о валентности и на многочисленных опытных данных, полученных исследователями при изучении зависимости теплового эффекта сгорания вещества от его химического строения [1,8].
Реакция сгорания вещества в атмосфере кислорода имеет вид
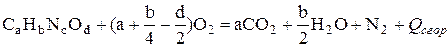 . (4.16)
. (4.16)
Используя закон Гесса для условий сгорания ВВ, определим теплоту его образования.
По закону Гесса
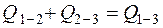 . (4.17)
. (4.17)
Здесь 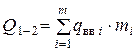 - суммарная теплота образования ВВ или его компонентов с учетом числа их грамм-молей -
- суммарная теплота образования ВВ или его компонентов с учетом числа их грамм-молей - 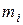 кДж/моль (ккал/моль);
кДж/моль (ккал/моль);
 |
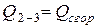 - теплота сгорания ВВ, кДж/моль (ккал/моль);
- теплота сгорания ВВ, кДж/моль (ккал/моль);
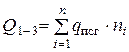 - суммарная теплота образования продуктов сгорания с учетом числа их грамм-молей -
- суммарная теплота образования продуктов сгорания с учетом числа их грамм-молей - 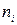 , кДж/моль (ккал/моль).
, кДж/моль (ккал/моль).
Откуда теплота образования ВВ
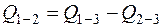 ,
,
или
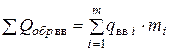 =
= 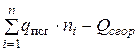 . (4.18)
. (4.18)
При разработке метода Караш исходил из следующих положений:
- сгорание органического соединения связано с перемещением электронов от атомов углерода и водорода к кислороду;
- теплота сгорания есть функция общего числа перемещающихся электронов.
При перемещении одного электрона из связи CH4 в соединения типа CO2 или H2O выделяется энергия 26,051) ккал/г-моль.
Тогда теплота сгорания простейших органических соединений при постоянном давлении может быть вычислена по формуле
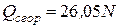 , ккал/г-моль, (4.19)
, ккал/г-моль, (4.19)
где 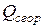 - теплота сгорания органического соединения, ккал/г-моль;
- теплота сгорания органического соединения, ккал/г-моль;
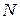 - число перемещающихся электронов при сгорании одной молекулы вещества.
- число перемещающихся электронов при сгорании одной молекулы вещества.
Учитывая, что любое органическое соединение может рассматриваться как углеводород, в котором несколько атомов водорода замещены на другие атомы или группы атомов Караш в формулу (4.20) вводит поправки
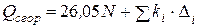 , (4.20)
, (4.20)
где 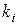 - число одинаковых заместителей в молекуле;
- число одинаковых заместителей в молекуле;
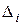 - соответствующая данному заместителю поправка.
- соответствующая данному заместителю поправка.
Численные значения тепловых поправок приведены в табл. 4.3.
Для подсчета числа смещающихся электронов Караш предлагает пользоваться нижеприведенными формулами [8]:
- для углеводородов типа CаHb
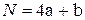 ; (4.21)
; (4.21)
- для соединений типа CaHbOd и соединений с 3 валентным азотом, не содержащих нитрогруппы 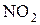 типа CaHbNcOd
типа CaHbNcOd
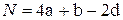 ; (4.22)
; (4.22)
- для нитросоединений типа CaHbNcOd(NO2)p
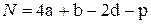 . (4.23)
. (4.23)
Здесь р – число нитрогрупп - NO2.
Основываясь на методе Караша для вычисления теплот сгорания, теплоту образования вещества можно определить по формуле

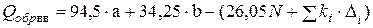 , (4.24)
, (4.24)
где 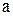 - число атомов углерода;
- число атомов углерода;
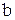 - число атомов водорода.
- число атомов водорода.
Таблица 4.3
Численные значения поправок для расчета теплот сгорания и образования по Карашу [8]
| № пп | Характеристика группировок, заместителей и связей | Тепловые поправки 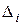 , ккал/моль1) , ккал/моль1)
|
| 1. | Связь между алифатическим и ароматическим радикалами R − Al | −3,5 |
| 2. | Связь между ароматическими радикалами R − R | −6,5 |
| 3. | Связь между ароматическим радикалом и гидроксильной группой R − OH | +3,5 |
| 4. | Связь между первичным алифатическим радикалом и гидроксильной группой Al − OH | +13,0 |
| 5. | Нитрогруппа − NO2 в алифатических и ароматических соединениях | +13,0 |
| 6. | Нитрогруппа, связанная с атомом азота 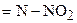
| −3,8 |
| 7. | Ароматические нитриды 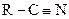
| −6,5 |
| 8. | Связь конденсированных ароматических ядер | −20,0 |
| 9. | Первичные алифатические амины 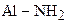
| +13,0 |
| 10. | Эфиры жирные и ароматические 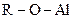
| +19,5 |
| 11. | Ацетиленовая связь 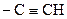
| +46,1 |
| 12. | Сложные эфиры алифатических кислот | +13,5 |
| 13. | Сложные эфиры ароматических кислот | +10,0 |
| 14. | Сложные эфиры азотной кислоты |
Примечание 1) − по данным [8].
Пример 4.4. Определить теплоту сгорания и образования тротила C7H5(NO2)3.
В соответствии с (4.23) получаем
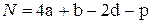 =
= 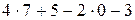 =30.
=30.
Теплота сгорания по формуле (4.20), учитывая поправку на группу 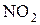 Δ1 = +13 (табл. 4.3), равна
Δ1 = +13 (табл. 4.3), равна
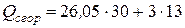 =820,5 ккал/моль.
=820,5 ккал/моль.
Откуда по формуле (4.24) теплота образования равна
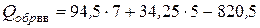 =12,25 ккал/моль.
=12,25 ккал/моль.
Некоторое расхождение с известными данными ( 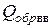 ≈13 ккал/моль) связано с необходимостью учитывать энергию на плавление тротила как твердого вещества [1].
≈13 ккал/моль) связано с необходимостью учитывать энергию на плавление тротила как твердого вещества [1].
Пример 4.5. Определить по методу Караша теплоту образования пикриновой кислоты C6H2(NO2)3OH или C6H3O(NO2)3.
В соответствии с химической формулой a= 6, b= 3, d = 1, p = 3, откуда по (4.23)
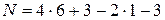 = 22.
= 22.
Теплота сгорания по формуле (4.20), учитывая поправку на группу 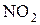 Δ1 = +13 и на группу OH Δ2 = +3,5 (табл. 4.3), равна
Δ1 = +13 и на группу OH Δ2 = +3,5 (табл. 4.3), равна
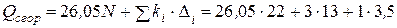 = 615,6 ккал/моль.
= 615,6 ккал/моль.
По формуле (4.24) находим теплоту образования пикриновой кислоты
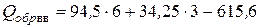 = 54,15 ккал/моль.
= 54,15 ккал/моль.
Дата добавления: 2017-08-01; просмотров: 6159;
