ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ
Это углеводороды открытого строения с одной двойной связью. Общая молекулярны формула СnН2n (содержит на два атома водорода меньше по сравнению с парафинами).
| Гомологический ряд | Тривиальное название | |
| С2Н4 | СН2=СН2 | Этилен |
| С3Н6 | СН2=СН-СН3 | Пропилен |
| С4Н8 | СН2=СН-СН2-СН3 | 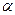 -бутилен -бутилен
|
| СН3-СН=СН-СН3 | 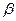 -бутилен -бутилен
| |
| СН2=С-СН3 СН3 | Изобутилен |
Тривиальное название отличается от названия соответствующих предельных углеводородов окончанием "илен".
Углеводород С4Н8 имеет и структурные, и пространственные изомеры.
Структурная изомерия представлена изомерией цепи
СН2=СН-СН2-СН3 и СН2=С-СН3
СН3
и изомерией положения двойной связи
СН2=СН-СН2-СН3 и СН3-СН=СН-СН3.
Пространственная изомерия наблюдается тогда, когда оба ненасыщенных атома углерода имеют хотя бы по одному заместителю. Например, СН3-СН=СН-СН3, так как относительно двойной связи нет свободного вращения, положение групп, связанных с ненасыщенным атомом углерода, является фиксированным в пространстве, при этом может быть два различных соединения, а именно:
H H CH3 H
C=C C=C
CH3 CH3 H CH3
цис-изомер транс-изомер
Этот вид изомерии называется геометрической или цис-транс-измоерией. Цис-изомеры более полярны и имеют более высокие температуры кипения.
Номенклатура
Рациональная номенклатура рассматривает этиленовые углеводороды как производные простейшего члена ряда – этилена.
| Рациональная | IUPAC | |
| СН3-СН=СН2 | метилэтилен | пропен |
| СН3-СН-СН=СН2 | этилэтилен | 1-бутен |
| СН3-СН=СН-СН3 | Sim диметилэтилен | 2-бутен |
| СН3-С=СН2 СН3 | Asim диметилэтилен | 2-метил-1-пропен |
Систематическая номенклатура. За основу беертся самая длинная углеродная цепь, в состав которой входит двойная связь. Эта цепь нумеруется с того конца, к которому ближе расположена двойная связь; радикалы, не вошедшие в основную цепь, перечисляются вначале названия. Положение их указывается цифрами, затем идет название основы, которая строится аналогично названию предельного углеводорода с заменой суффикса "ан" на "ен". Положение двойной связи указывается меньшей цифрой перед названием основы.
Способы получения
1.Дегидрогенизация и крекинг предельных углеводородов (промышленные методы получения) см. свойства парафинов.
2.Отщепление галогеноводорода от моногалогенопроизводных предельных углеводородов.
H H
H-C-C-H 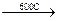 HCl + CH2=CH2
HCl + CH2=CH2
H Cl
хлористый этил
Реакция идет при более мягких условиях, если действовать спиртовым раствором целочи
H H
CH3-C-C-CH3 + KOH 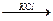 CH3-CH=CH-CH3
CH3-CH=CH-CH3
Cl H (спирт) -H2O 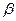 -бутилен
-бутилен
хлористый вторбутил
Реакция протекает согласно правила Зайцева: водород отщепляется от наменее гидрированного из двух соседних с галогеносодержащим атомов углерода, т.к. термодинамически более устойчивы олефины, у которых непредельные атомы углерода связаны с алкилами, а не с водородом.
H H
H-C-CH=CH-C-H 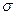 -
- 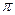 -сопряжение с участием 12
-сопряжение с участием 12 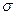 -электронов
-электронов
H H С-Н связей
3.Дегидратация спиртов протекает в присутствии сильных минеральных кислот (Н2S04, H3PO4).
OH
СH3-CH-CH2-CH3 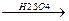 CH3-CH=CH-CH3 + H2O
CH3-CH=CH-CH3 + H2O
вторичный бутиловый спирт 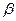 -бутилен
-бутилен
4.Отщепление 2-х атомов галогена от вицинальных дигалогенопроизводных углеводородов.
СH2-CH2 + Zn 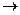 ZnBr2 + CH2=CH2
ZnBr2 + CH2=CH2
Br Br
5. Частичное гидрирование ацетиленовых углеводородов
CH 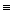 CH + H2
CH + H2 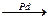 CH2=CH2
CH2=CH2
Дата добавления: 2017-06-02; просмотров: 1234;
