Классификация органических реакций по механизму
Механизмы реакций органических соединений зависят от того, каким образом разрушаются химические связи.
Ковалентная связь может разрушаться двумя основными способами:
1.Разрыв связи, происходящий с разъединением электронной пары, называется гомолитическим расщеплением.
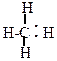
|
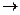
| 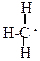
| + . H |
Промежуточно при этом образуются активные незаряженные частицы, имеющие неспаренный электрон, свободные радикалы. Так как эти частицы не заряжены – реакции, протекающие с их участием, называют гомеополярными или свободно-радикальными. Образование новой химической связи в этих реакциях идет за счет обобщения неспаренного электрона углерода с неспаренным электроном реагента, например:
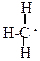
| + Cl : Cl |
| 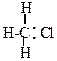
| + Cl . |
Гомеополярные реакции имеют преимущественное значение для соединений с неполярными или малополярными связями.
2. Разрыв связи, происходящий без разъединения электронной пары, называется гетеролитическим расщеплением.
Гетеролитическое расщепление связи приводит к образованию частиц с противоположными зарядами, поэтому такие реакции называются гетерополярными.
Существуют два вида гетерополярных реакций:
а)электронная пара разрушающейся связи остается у атома углерода.
Например:
Н\ Н\
Н-C:Н ® Н-C -: + Н+
Н/ Н/
КАРБАНИОН
Образующийся отрицательно заряженный карбониевый ион носит название карбаниона. Образование новой связи в этом случае идет за счет обобщения оставшейся свободной пары электронов углерода с реагентом, который должен иметь положительный заряд или обладать секстетом электронов. Реагент в таких реакциях является частицей электрофильной, поэтому механизм реакции тоже называют электрофильным.
 Н \ + - Н \
Н \ + - Н \

 Н-С- :+Вr : Вr Н-С-Вr + Вr -
Н-С- :+Вr : Вr Н-С-Вr + Вr -
Н / Н /
б)электронная пара разрушающейся связи отрывается от углерода. Например:
Н\ Н\
H-C:Cl ® H-C + + :Cl-
H/ H/
КАРБКАТИОН
Образуется положительно заряженный углеродный ион, который носит название карбкатиона. Образование новых связей в этом случае происходит за счет обобщения пары электронов реагента, который должен иметь или отрицательный заряд, или неподеленную пару электронов. Например:
Н \ Н\
 Н-С+ + К+ОН- Н-С-ОН + К+
Н-С+ + К+ОН- Н-С-ОН + К+
Н / Н/
Реагент является частицей нуклеофильной, механизм реакции также называется нуклеофильным.
Все гетерополярные реакции легче протекают для соединений с полярными или легко поляризующимися связями и под действием полярных реагентов.
Кроме классификации по механизму, реакции различаются по типам (направлению реакций), например, замещения (S – substitution), присоединения (A – adduction), отщепления (E – elimination), и по молекулярности, по порядку медленной стадии реакции. определяющей скорость всего процесса (моно-, бимолекулярные и др.). Например:
 С2Н5ОН + НBr H2O + C2H5Br протекает по механизму SN2 - бимолекулярная реакция нуклеофильного замещения.
С2Н5ОН + НBr H2O + C2H5Br протекает по механизму SN2 - бимолекулярная реакция нуклеофильного замещения.
r=K[C2H5OH][HBr]
Лекция № 2
Дата добавления: 2017-06-02; просмотров: 953;
