Основные характеристики ковалентных связей
Полярность
Обуславливается различной электроотрицательностью соединя-ющихся атомов.
Величина электроотрицательности Х вычисляется как полусумма энергии сродства к электрону (энергии, выделяющейся при присоединении электрона к атому) и энергии ионизации (энергии, которая затрачивается для отрыва электрона от атома).
Х = ½ (Е + I)
Электроотрицательность характеризует способность атома притягивать к себе электронное облако связи. По шкале Полинга относительная величина электроотрицатеьности уменьшается в ряду:
| F | O | N | C | H | эл.вольт/ г-экв. |
| 4,0 | 3,5 | 3,0 | 2,5 | 2,1 |
Если разница в электроотрицательности 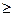 1,7, то общая электронная пара целиком переходит к более электроотрицательному атому и образуется ионная связь. При разнице <1,7 образуется связь ковалентная полярная.
1,7, то общая электронная пара целиком переходит к более электроотрицательному атому и образуется ионная связь. При разнице <1,7 образуется связь ковалентная полярная.
Область максимальной электронной плотности смещена к более электроотрицательному атому.
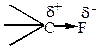
Если атомы имеют одинаковую электроотрицательность, и две части молекулы симметричны, то связь неполярная: СН3-СН3. Полярность связи может быть охарактеризована величиной дипольного момента связи, который можно рассматривать как произведение расстояния между центрами тяжести положительного и отрицательного заряда l на абсолютную величину сосредоточенного в этих центрах заряда е.
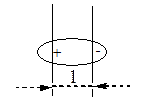
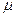 = l . e
= l . e
Полярность кратных связей в несколько раз выше, чем простых, т.к. p-электроны очень подвижны и смещаются сильнее, чем s-электроны. Из всех ковалентных связей наиболее полярными являются координационные.
Поляризуемость
Это способность электронного облака ковалентной связи деформироваться под действием внешних условий (полярного растворителя или реагента). Например:
d+ d- d+ d- d+ d-
 СН2=СН2 + Вr-Br СН2=СН2 …Вr-Вr
СН2=СН2 + Вr-Br СН2=СН2 …Вr-Вr
(бромная вода)
Вследствие смещения электронного облака к одному из атомов у него возникает дробный отрицательный заряд, а у другого такой же по величине дробный положительный заряд. Наиболее легко поляризуются кратные связи, благодаря высокой подвижности p -электронов.
Чем меньше электроотрицательность атома, тем он слабее удерживает электроны, тем легче поляризуется связь.
Например, поляризуемость связи
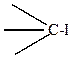
гораздо больше, чем связи
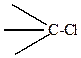
поэтому йодпроизводные легче дают реакции замещения галогена, чем хлорпроизводные, хотя полярность связи
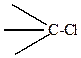
больше.
Дата добавления: 2017-06-02; просмотров: 612;
