Гидрофильно- липофильный баланс
Свойства ПАВ определяются количественным соотношением гидрофильных и липофильных групп в его составе (ГЛС) или гидрофильно-липофильным балансом (ГЛБ). Впервые количественное значение ГЛБ было предложено и эмпирически определено Гриффином [2,3] для описания эффективности действия ПАВ в качестве эмульгаторов первого или второго рода. ( Эмульгатор первого рода стабилизирует эмульсии масло/вода, эмульгатор второго рода является стабилизатором эмульсии вода/масло). Система ГЛБ имеет шкалу от 0 до 40; ПАВ с выраженными липофильными свойствами (растворимые в органических растворителях) имеют низкие значения ГЛБ, а гидрофильные вещества — высокое. Шкала Гриффина с самого начала была рассчитана на практическое применение (подбор нужного эмульгатора) и получила широкое распространение [20Р]: наличие у каждого ПАВ своего числа ГЛБ позволяло составлять без труда рецепты смесей ПАВ с нужным числом ГЛБ. Ниже приводятся примерные пределы чисел ГЛБ и соответствующие им применения ПАВ [0-12А]:
3,5—6 Эмульгаторы второго рода
7—9 Смачиватели
8— 18 Эмульгаторы первого рода
13—15 Моющие агенты (детергенты)
15—18 Солюбилизаторы
Чтобы найти число ГЛБ для конкретного ПАВ, необходимо испытать его в сравнении с уже известными веществами и найти ему место в пределах шкалы. Попытка создания теоретической базы ГЛБ была предпринята Дэвисом. Он подобрал так называемые групповые числа, т. е. числа ГЛБ не для молекул в целом, а для составляющих их групп (структурных единиц молекулы). При сложении этих чисел получается ГЛБ ПАВ по формуле:
ГЛБ = Σ гидрофильных групповых чисел +
+ Σ гидрофобных групповых чисел + 7
Ниже приводятся значения групповых чисел ГЛБ по Дэвису:
| Гидрофильные группы | Групповые числа |
| —S04Na | 38,7 |
| —COOK | 21,1 |
| —COONa | 19,1 |
| —N (четвертичных аминов) | 9,4 |
| Эфир (сорбитановое кольцо) | 6,8 |
| Эфир (свободный) | 2,4 |
| —О— | 1,3 |
| —СООН— | 2,1 |
| —ОН (свободный) | 1,9 |
| —ОН (сорбитановое кольцо) | 0,5 |
| Липофильные группы | |
| —СН - , —СН2—, —СНз, =СН- | -0,475 |
| Производные группы | |
| —СН2СН20— | 0,33 |
| —СН2СН2СН20— | -0,15 |
Эта система дает общие представления о свойствах вещества и удовлетворительно объясняет качественно поведение ПАВ, однако она не позволяет осуществить количественных расчетов — в этом ее основной недостаток. С помощью ГЛБ можно прогнозировать в первую очередь эмульгирующие свойства поверхностно-активных веществ.
О процессах флотации, моющем действии, гидрофобизации, диспергировании и других с помощью ГЛБ судить практически невозможно.
Мицеллообразование
Перевод малорастворимых веществ в растворенное состояние и является необходимым условием для проведения многих технологических процессов, таких как подготовка (отварка, беление) и колорирование текстильных материалов. Увеличить растворимость гидрофобных веществ в воде можно с помощью ПАВ. В основе этого процесса лежат явления мицеллообразования и солюбилизации.
Мицеллообразование это обратимый процесс ассоциации молекул поверхностно-активных веществ в объеме раствора с образованием термодинамически устойчивых более крупных частиц - мицелл. Процесс мицеллообразования впервые был описан Мак-Беном в 1913 году. Причиной мицеллообразования является дуализм строения молекул ПАВ. В основе современных представлений о структуре мицелл, образующихся в водных растворах, расположена в основном модель Хартли [4 ], согласно которой гидрофобные части молекул при образовании в воде мицеллы составляют углеводородное ядро, окруженное слоем полярных групп, имеющих ионный, неионогенный или амфолитный характер (прямые мицеллы). В неполярных средах образуются мицеллы, внутри которых находятся полярные группы, а углеводородные цепи обращены наружу (обратные мицеллы).
Не все поверхностно-активные вещества могут образовывать мицеллы. Способностью к мицеллообразованию обладают все синтетические и природные ПАВ, молекулы которых имеют гибкие алкильные цепи с числом углеродных атомов выше 7, сбалансированные одной или более гидрофильными группами, и обладают мощными «плечами» ГЛБ, в частности сильными полярными группами, а также пространственной структурой, подходящей для упаковки в мицеллы. Эта большая группа ПАВ называется мицеллообразующими или коллоидными.
Мицеллы могут иметь сферическую, эллипсоидную, цилиндрическую или пластинчатую форму (рис. 1).Число молекул ПАВ, входящих в мицеллу, называют числом агрегации. Процесс образования мицелл рассматривают как постепенную ассоциацию молекул ПАВ и их агрегатов или как фазовый переход второго рода. Мицеллы бывают различных размеров, числа агрегации ПАВ в мицеллах могут варьироваться от нескольких десятков до нескольких сотен в зависимости от концентрации ПАВ в растворе и присутствия других веществ, например электролитов и красителей. Общую сумму молекулярных масс молекул (ионов), входящих в мицеллу, называют мицеллярной массой.
Как прямая, так и обратная мицеллы имеют слоистое строение. В водном растворе для мицелл характерны следующие элементы: углеводородное ядро; водно-углеводородный слой, толщина которого (обычно 2—3 группы СН2) соответствует глубине проникновения молекул воды внутрь углеводородной части мицеллы или, наоборот, углеводородных цепей внутрь водной фазы; слой гидратированных полярных групп; прилегающий к мицелле неоднородный слой раствора (для ионных мицелл это диффузная часть двойного электрического слоя).
Концентрация ПАВ, при которой происходит образование мицелл, называется критической концентрацией мицеллообразования.
Более подробно рассмотрим основные характеристики прямых мицелл неионогенных ПАВ и экспериментальные методы их определения. (Потешнова)
Растворимость неионогенных ПАВ в воде обусловлена наличием в их молекулах гидрофильных эфирных и гидроксильных групп, чаще всего полиэтиленгликолевой цепи. При растворении НПАВ происходит гидратация оксиэтильных цепей вследствие образования водородных связей между кислородными атомами полиэтиленгликолевого остатка и молекулами воды. Повышение температуры вызывает разрушение водородных связей и растворимость НПАВ уменьшается, поэтому для них точка помутнения (Тпом) - верхний температурный предел мицеллообразования - является важным показателем. Способностью к мицеллообразованию обладают не все ПАВ, а только те, которые имеют хорошо выраженные гидрофильные и гидрофобные части и оптимальные соотношения между ними, что определяется величиной гидрофильно-липофильного баланса (ГЛБ), а также пространственной структурой, подходящей для упаковки в мицеллы [1]. Постепенное увеличение концентрации НПАВ свыше ККМ в растворах или повышение температуры (при Т< Тпом) может вызывать полиморфные превращения мицелл, т.е. изменение их формы от сферической к цилиндрической и далее к пластинчатой. При высоких концентрациях НПАВ мицеллы могут образовывать жидкокристаллические фазы: кубическую, гексагональную, ламеллярную. Схематичное изображение некоторых типов самоорганизованных молекулярных ансамблей НПАВ, приведенное в монографии Шенфельда Н. [2], представлено на рис. 1. В работах Русанова А.И. [1], Mitchell D. at all [3], Langevin D. [4] рассмотрена зависимость формы мицелл от величины геометрического фактора - νh/(lcа0), где vh и lc - соответственно объем и длина гидрофобного радикала, а0 - площадь, приходящаяся на полярную группу молекулы ПАВ на поверхности углеводородного ядра мицеллы. Показано [1,3,4], что при значениях фактора νh/(lcа0)≤1/3 образуются сферические мицеллы, при 1/3 < νh/(lcа0)≤1/2 - цилиндрические, а при 1 /2< νh/(lcа0)≤1 - везикулы или бислои.
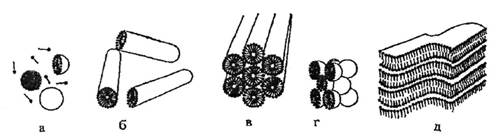
Рис. 1. Некоторые типы самоорганизованных ансамблей молекул НПАВ в водной среде [2]: аи б- соответственно сферические и цилиндрические мицеллы; в, г и д - соответственно жидкокристаллические гексагональная, кубическая и ламеллярная фазы. На схеме, для простоты изображения, углеводородные радикалы молекулы НПАВ представлены в виде отрезков, а оксиэтильные цепи -точками.
Схема строения сферической мицеллы неионогенного ПАВ в водной среде, приведенная в сборнике статей под редакцией Миттела К. [5], изображена на рис. 2. Из рис. 2 видно, что гидрофобные радикалы находятся внутри мицеллы, образуя углеводородное ядро, а гидратированные оксиэтильные цепи образуют оксиэтильную оболочку вокруг этого ядра Методом ядерного магнитного резонанса (ЯМР) было показано [6], что углеводородное ядро мицеллы НПАВ подобно жидкости, оно менее полярно, чем индивидуальное НПАВ и непроницаемо для молекул воды, при этом подвижность оксиэтильной цепи увеличивается в направлении к концевой гидроксильной группе, а подвижность молекул воды, находящихся между оксиэтильными цепями, ограничена.
Строение мицеллы НПАВ в водной среде полностью определяется такими параметрами, как форма, размер, мицеллярная масса или число агрегации (количество молекул, входящих в мицеллу) и степень гидратации мицеллы. Радиус сферических мицелл НПАВ, как правило, составляет величину около 3-5 нм. Молекулярная масса мицеллы колеблется в пределах 103-105. Число агрегации сферической мицеллы (N), т.е. число молекул НПАВ, образующих мицеллу, обычно составляет величину порядка нескольких десятков молекул. Степень гидратации мицелл НПАВ (nW/OE) обычно выражается числом молекул воды, приходящихся на одно оксиэтильное звено молекулы НПАВ [2]. Для сферических мицелл значения nW/OE могут колебаться в широких пределах 0,04-6,91 [37], что связано с тем обстоятельством, что помимо гидратной воды, непосредственно связанной водородными связями с эфирными атомами кислорода оксиэтильной цепи, в полярной части мицелл НПАВ может находится значительное количество воды, заключенное в пространстве между закрученными оксиэтильными цепями [7, 37]. Поэтому исследуя степень гидратации мицеллы, можно оценить конформацию оксиэтильных цепей молекул НПАВ, ассоциированных в мицеллы.
|
|
|
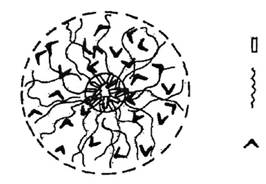
Рис.2. Модель мицеллы неионогенного ПАВ в водной среде [5].
Спектр методов исследования структуры мицеллярных растворов НПАВ очень широк. Для определения чисел агрегации или молекулярной массы негидратированных мицелл используются методы статического рассеяния света (СРС) [11, 21], тушения люминесценции [17, 47], солюбилизации красителя [16, 37, 38], малоуглового рассеяния нейтронов [29, 30]. Для определения размеров гидратированных мицелл используются методы динамического рассеяния света (ДРС) [11, 18], вискозиметрии [21, 35, 37, 40, 47, 48], седиментации с использованием ультрацентрифуги [20, 21, 33, 37], кондуктометрии в присутствии незначительных добавок сильного электролита [24, 40, 48], ЯМР [6, 27, 47]. Степень гидратации мицеллы обычно рассчитывают по разности объемов гидратированной и негидратированной мицеллы. Определение формы мицелл может быть выполнено такими современными методами, как электронная микроскопия [8, 9], малоугловое рассеяние нейтронов [29, 46] или рентгеновских лучей [41]. Однако чаще всего анализ формы мицелл проводится на основе совокупности данных вискозиметрии, дилатометрии и результатов определения степени гидратации мицеллы [40, 48]. Сопоставление различных методов исследования, позволяющих определять характеристики мицелл в растворах ПАВ (средний размер и форма, распределение по размерам), выполнено в обзорной работе Рохленко А. [10]. Следует подчеркнуть, что исследование водных растворов НПАВ в области ККМ является трудной экспериментальной задачей и требует использования высокочувствительных приборов, поскольку значения ККМ НПАВ много меньше, чем ионогенных поверхностно-активных веществ.
Дополнительная лит-ра: А.А.Агеев, В.А. Волков Поверхностные явления и дисперсные системы в производстве текстильных материалов и химических волокон. Учебник для вузов.-М:МГТУ им. А.М.Косыгина,2004.-464с.
Солюбилизация
Согласно современным представлениям (взглядам) солюбилизацией называют равновесный процесс растворения в мицеллах нерастворимых в воде или в других растворителях веществ [9-11 ].Мицеллообразующее ПАВ в таком случае называют солюбилизатором, а солюбилизируемое вещество –солюбилизатом. В зависимости от структуры солюбилизата в процессе могут участвовать различные связывающие центры мицеллы, внутри которых солюбилизируемые молекулы ориентируются различным образом (рис2). Основными факторами, определяющими солюбилизирующую способность водного раствора ПАВ, являются: структура ПАВ, структура солюбилизата, температура раствора, влияние добавок других химических соединений, например, таких как со-ПАВ, низкомолекулярных и высокомолекулярных электролитов. В пределах гомологического ряда солюбилизирующая способность ПАВ возрастает с увеличением длины углеводородного радикала[ ] и концентрации ПАВ в растворе [ ]. В общем случае солюбилизирующая способность максимальна у поверхностно-активных веществ с некоторой средней длиной алифатической цепи в пределах гомологического ряда от С12 до С16 , но вместе с тем зависит и от природы функциональных групп, присутствующих в радикале. Например, наличие эфирного кислорода или фенольной группы в углеродной цепи четвертичных аммониевых солей повышает солюбилизирующую способность катионных ПАВ по отношению к этилбензолу[ ].
Дата добавления: 2017-06-02; просмотров: 5145;
