Тангенциальная составляющая ускорения 13 страница
Кристаллические тела можно разделить на две группы: монокристаллы и поликристаллы. Монокристаллы — твердые тела, частицы которых образуют единую кристаллическую решетку. Кристаллическая структура монокристаллов обнаруживается по их внешней форме. Хотя внешняя форма монокристаллов одного типа может быть различной, но углы между соответствующими гранями у них остаются постоянными. Это закон постоянства углов, сформулированный М. В. Ломоносовым. Он сделал важный вывод, что правильная форма кристаллов связана с закономерным размещением частиц, образующих кристалл. Монокристаллами являются большинство минералов. Однако крупные природные монокристаллы встречаются довольно редко (например, лед, поваренная соль, исландский шпат). В настоящее время многие монокристаллы выращиваются искусственно. Условия роста крупных монокристаллов (чистый раствор, медленное охлаждение и т. д.) часто не выдерживаются, поэтому большинство твердых тел имеет мелкокристаллическую структуру, т. е. состоит из множества беспорядочно ориентированных мелких кристаллических зерен. Такие твердые тела называются поликристаллами (многие горные породы, металлы и сплавы).
Характерной особенностью монокристаллов является их анизотропность, т. е. зависимость физических свойств — упругих, механических, тепловых, электрических, магнитных, оптических — от направления. Анизотропия монокристаллов объясняется тем, что в кристаллической решетке различно число частиц, приходящихся на одинаковые по длине, но разные по направлению отрезки (рис. 102), т. е. плотность расположения частиц кристаллической решетки по разным направлениям неодинакова, что и приводит к различию свойств кристалла вдоль этих направлений. В поликристаллах анизотропия наблюдается только для отдельных мелких кристалликов, но их различная ориентация приводит к тому, что свойства поликристалла по всем направлениям в среднем одинаковы.

.
§ 71. Типы кристаллических твердых тел
Существует два признака для классификации кристаллов: 1) кристаллографический; 2) физический (природа частиц, расположенных в узлах кристаллической решетки, и характер сил взаимодействия между ними).
1. Кристаллографический признак кристаллов. В данном случае важна только пространственная периодичность в расположении частиц, поэтому можно отвлечься от их внутренней структуры, рассматривая частицы как геометрические точки.
Кристаллическая решетка может обладать различными видами симметрии. Симметрия кристаллической решетки — ее свойство совмещаться с собой при некоторых пространственных перемещениях, например параллельных переносах, поворотах, отражениях или их комбинациях и т. д. Кристаллической решетке, как доказал русский кристаллограф Е. С. Федоров (1853—1919), присущи 230 комбинаций элементов симметрии, или 230 различных пространственных групп.
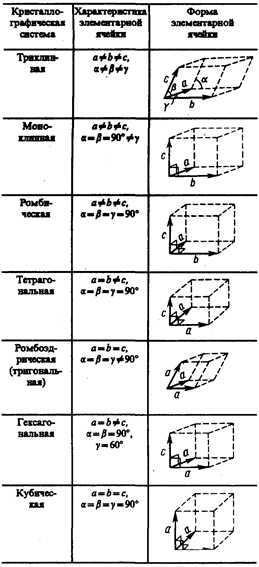
С переносной симметрией в трехмерном пространстве связывают понятие трехмерной периодической структуры — пространственной решетки, или решетки Бравэ, представление о которой введено французским кристаллографом О. Бравэ (1811—1863). Всякая пространственная решетка может быть составлена повторением в трех различных направлениях одного и того же структурного элемента — элементарной ячейки. Всего существует 14 типов решеток Бравэ, различающихся по виду переносной симметрии. Они распределяются по семи кристаллографическим системам, или сингониям, представленным в порядке возрастающей симметрии в табл. 3. Для описания элементарных ячеек пользуются кристаллографическими осями координат, которые проводят параллельно ребрам элементарной ячейки, а начало координат выбирают в левом углу передней грани элементарной ячейки. Элементарная кристаллическая ячейка представляет собой параллелепипед, построенный на ребрах а, b, с с углами a, b и g между ребрами (табл. 3). Величины а, b и с и a, b и g называются параметрами элементарной ячейки и однозначно ее определяют.
2. Физический признак кристаллов. В зависимости от рода частиц, расположенных в узлах кристаллической решетки, и характера сил взаимодействия между ними кристаллы разделяются на четыре типа: ионные, атомные, металлические, молекулярные.
Ионные кристаллы. В узлах кристаллической решетки располагаются поочередно ионы противоположного знака. Типичными ионными кристаллами являются большинство галоидных соединений щелочных металлов (NaCl, CsCl, КВr и т. д.), а также оксидов различных элементов (MgO, СаО и т. д.). Структуры решеток двух наиболее характерных ионных кристаллов — NaCl (решетка представляет собой две одинаковые гранецентрированные кубические решетки, вложенные друг в друга; в узлах одной из этих решеток находятся ионы Na+, в узлах другой — ионы Cl–) и CsCl (кубическая объемно центрированная решетка — в центре каждой элементарной решетки находится ион) — показаны на рис. 103. Силы взаимодействия между ионами являются в основном электростатическими (кулоновскими).Связь, обусловленная кулоновскими силами притяжения между разноименно заряженными ионами, называетсяионной (илигетерополярной).В ионной решетке нельзя выделить отдельные молекулы: кристалл представляет собойкак бы одну гигантскую молекулу.
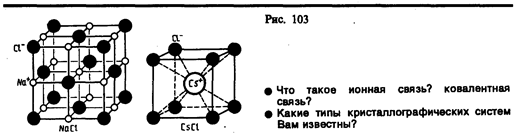
Таблица 3
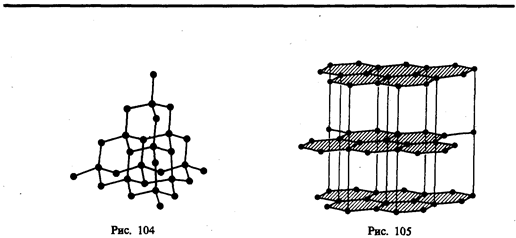
Атомные кристаллы. В узлах кристаллической решетки располагаются нейтральные атомы, удерживающиеся в узлах решеткигомеополярными, или ковалентными, связями квантово-механического происхождения (у соседних атомов обобществлены валентные электроны, наименее связанные с атомом). Атомными кристаллами являются алмаз и графит (два различных состояния углерода), некоторые неорганические соединения (ZnS, ВеО и т. д.), а также типичные полупроводники — германий Ge и кремний Si. Структура решетки алмаза приведена на рис. 104, где каждый атом углерода окружен четырьмя такими же атомами, которые располагаются на одинаковых расстояниях от него в вершинах тетраэдров.
Валентные связи осуществляются парами электронов, движущихся по орбитам, охватывающим оба атома, и носят направленный характер: ковалентные силы направлены от центрального атома к вершинам тетраэдра. В отличие от графита решетка алмаза не содержит плоских слоев, что не позволяет сдвигать отдельные участки кристалла, поэтому алмаз является прочным соединением.
Металлические кристаллы. В узлах кристаллической решетки располагаются положительные ионы металла. При образовании кристаллической решетки валентные электроны, сравнительно слабо связанные с атомами, отделяются от атомов и коллективизируются: они уже принадлежат не одному атому, как в случае ионной связи, и не паре соседних атомов, как в случае гомеополярной связи, а всему кристаллу в целом. Таким образом, в металлах между положительными ионами хаотически, подобно молекулам газа, движутся «свободные» электроны, наличие которых обеспечивает хорошую электропроводность металлов. Так как металлическая связь не имеет направленного действия и положительные ионы решетки одинаковы по свойствам, то металлы должны иметь симметрию высокого порядка. Действительно, большинство металлов имеют кубическую объемно центрированную (Li, Na, К, Rb, Cs) и кубическую гранецентрированную (Сu, Ag, Pt, Au) решетки. Чаще всего металлы встречаются в виде поликристаллов.
Молекулярные кристаллы. В узлах кристаллической решетки располагаются нейтральные молекулы вещества, силы взаимодействия между которыми обусловлены незначительным взаимным смещением электронов в электронных оболочках атомов. Эта силы называются ван-дер-ваальсовыми, так как они имеют ту же природу, что и силы притяжения между молекулами, приводящими к отклонению газов от идеальности. Молекулярными кристаллами являются, например, большинство органических соединений (парафин, спирт, резина и т. д.), инертные газы (Ne, Аr, Кr, Хе) и газы СО2, О2, N2 в твердом состоянии, лед, а также кристаллы брома Вr2, иода I2. Ван-дер-ваальсовы силы довольно слабые, поэтому молекулярные кристаллы легко деформируются.
В некоторых твердых телах одновременно может осуществляться несколько видов связи. Примером может служить графит (гексагональная решетка). Решетка графита (рис. 105) состоит из ряда параллельных плоскостей, в которых атомы углерода расположены в вершинах правильных шестиугольников. Расстояние между плоскостями более чем в два раза превышает расстояние между атомами шестиугольника. Плоские слои связаны друг с другом ван-дер-ваальсовыми силами. В пределах слоя три валентных электрона каждого атома углерода образуют ковалентную связь с соседними атомами углерода, а четвертый электрон, оставаясь «свободным», коллективизируется, но не во всей решетке, как в случае металлов, а в пределах одного слоя. Таким образом, в данном случае осуществляются три вида связи: гомеополярная и металлическая — в пределах одного слоя; ван-дер-ваальсова — между слоями. Этим объясняется мягкость графита, так как его слон могут скользить друг относительно друга.
Различие в строении кристаллических решеток двух разновидностей углерода — графита и алмаза — объясняет различие в их физических свойствах: мягкость графита и твердость алмаза; графит — проводник электричества, алмаз — диэлектрик (нет свободных электронов) и т. д.
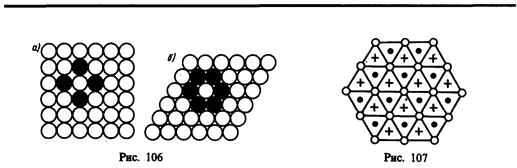
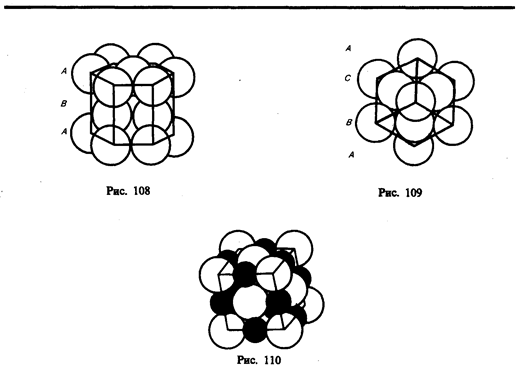
Расположение атомов в кристаллах характеризуется такжекоординационным числом — числом ближайших однотипных с данным атомом соседних атомов в кристаллической решетке или молекул в молекулярных кристаллах. Для модельного изображения кристаллических структур из атомов и ионов пользуются системой плотной упаковки шаров. Рассматривая простейший случай плотной упаковки шаров одинакового радиуса на плоскости, приходим к двум способам их расположения (рис. 106, а, б). Правая упаковка является более плотной, так как при равном числе шаров площадь ромба со стороной, равной стороне квадрата, меньше площади квадрата. Как видно из рисунка, различие в упаковках сводится к различию координационных чисел: в левой упаковке координационное число равно 4, в правой — 6, т. е. чем плотнее упаковка, тем больше координационное число.
Рассмотрим, при каких условиях плотная упаковка шаров в пространстве может соответствовать той или иной кристаллической структуре, приводимой ранее. Начнем строить решетку со слоя шаров, представленных на рис. 106, б. Для упрощения дальнейших рассуждений спроецируем центры шаров на плоскость, на которой они лежат, обозначив их белыми кружками (рис. 107). На эту же плоскость спроецируем центры просветов между шарами, которые обозначены на рис. 107 соответственно черными кружками и крестиками. Любой плотноупакованный слой будем называть слоем А, если центры его шаров расположены над серыми кружками, слоем В — если над красными кружками, слоем С — если над крестиками. Над слоем А уложим второй плотноупакованный слой так, чтобы каждый шар этого слоя лежал на трех шарах первого слоя. Это можно сделать двояко: взять в качестве второго слоя либо В, либо С. Третий слой можно опять уложить двояко и т. д. Итак, плотную упаковку можно описать как последовательность АВСВАС..., в которой не могут стоять рядом слои, обозначенные одинаковыми буквами.
Из множества возможных комбинаций в кристаллографии реальное значение имеют два типа упаковки: 1) двухслойная упаковка АВАВАВ... — гексагональная плотноупакованная структура (рис. 108); 2) трехслойная упаковка АВСАВС... — кубическая гранецентрированная структура (рис. 109). В обеих решетках координационное число равно 12 и плотность упаковки одинакова — атомы занимают 74% общего объема кристалла. Координационное число, соответствующее кубической объемно центрированной решетке, равно 8, решетке алмаза (см. рис. 104) равно 4.
Кроме двух- и трехслойных упаковок можно построить многослойные с большим периодом повторяемости одинаковых слоев, например АВСВАСАВСВАС... — шестислойная упаковка. Существует модификация карбида SiC с периодом повторяемости 6, 15 и 243 слоя.
Если кристалл построен из атомов различных элементов, то его можно представить в виде плотной упаковки шаров разных размеров. На рис. 110 приведено модельное изображение кристалла поваренной соли. Крупные ионы хлора (r=181 пм) образуют плотную трехслойную упаковку, у которой большие пустоты заполнены меньшими по размеру ионами натрия (r=98 пм). Каждый ион Na окружен шестью ионами Сl и, наоборот, каждый ион Cl — шестью ионами Na.
§ 72. Дефекты в кристаллах
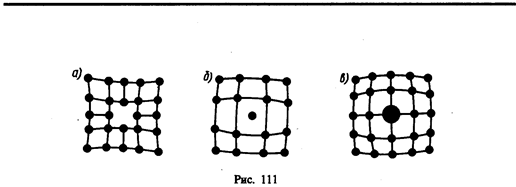
Рассмотренные в § 71 идеальные кристаллические структуры существуют лишь в очень малых объемах реальных кристаллов, в которых всегда имеются отклонения от упорядоченного расположения частиц в узлах решетки, называемые дефектами кристаллической решетки. Дефекты делятся на макроскопические, возникающие в процессе образования и роста кристаллов (например, трещины, поры, инородные макроскопические включения), и микроскопические, обусловленные микроскопическими отклонениями от периодичности.
Микродефекты делятся на точечные и линейные. Точечные дефекты бывают трех типов: 1) вакансии — отсутствие атома в узле кристаллической решетки (рис. 111, a); 2) междоузельный атом — атом, внедрившийся в междоузельное пространство (рис. 111, б); 3) примесный атом — атом примеси, либо замещающий атом основного вещества в кристаллической решетке (примесь замещения, рис. 111, в), либо внедрившийся в междоузельное пространство (примесь внедрения, рис. 111, б; только в междоузлии вместо атома основного вещества располагается атом примеси). Точечные дефекты нарушают лишь ближний порядок в кристаллах, не затрагивая дальнего порядка, — в этом состоит их характерная особенность.
Линейные дефекты нарушают дальний порядок. Как следует из опытов, механические свойства кристаллов в значительной степени определяются дефектами особого вида — дислокациями. Дислокации — линейные дефекты, нарушающие правильное чередование атомных плоскостей.
Дислокации бывают краевые и винтовые. Если одна из атомных плоскостей обрывается внутри кристалла, то край этой плоскости образует краевую дислокацию (рис. 112, а). В случае винтовой дислокации (рис. 112, б) ни одна из атомных плоскостей внутри кристалла не обрывается, а сами плоскости лишь приблизительно параллельны и смыкаются друг с другом так, что фактически кристалл состоит из одной атомной плоскости, изогнутой по винтовой поверхности.
Плотность дислокаций (число дислокаций, приходящихся на единицу площади поверхности кристалла) для совершенных монокристаллов составляет 102 — 103 см–2, для деформированных кристаллов — 1010 — 1012 см–2. Дислокации никогда не обрываются, они либо выходят на поверхность, либо разветвляются, поэтому в реальном кристалле образуются плоские или пространственные сетки дислокаций. Дислокации и их движение можно наблюдать с помощью электронного микроскопа, а также методом избирательного травления — в местах выхода дислокации на поверхность возникают ямки травления (интенсивное разрушение кристалла под действием реагента), «проявляющие» дислокации.
Наличие дефектов в кристаллической структуре влияет на свойства кристаллов, анализ которых проведем ниже.
§ 73. Теплоемкость твердых тел
В качестве модели твердого тела рассмотрим правильно построенную кристаллическую решетку, в узлах которой частицы (атомы, ионы, молекулы), принимаемые за материальные точки, колеблются около своих положений равновесия — узлов решетки — в трех взаимно перпендикулярных направлениях. Таким образом, каждой составляющей кристаллическую решетку частице приписывается три колебательных степени свободы, каждая из которых, согласно закону равнораспределения энергии по степеням свободы (см. § 50), обладает энергией kT.
Внутренняя энергия моля твердого тела
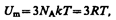
где NA — постоянная Авогадро; NAk=R (R — молярная газовая постоянная). Молярная теплоемкость твердого тела
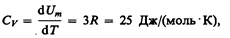 (73.1)
(73.1)
т. е. молярная (атомная) теплоемкость химически простых тел в кристаллическом
состоянии одинакова (равна 3R) и не зависит от температуры. Этот закон был эмпирически получен французскими учеными П. Дюлонгом (1785—1838) и Л. Пти (1791—1820) и носит названиезакона Дюлонга и Пти.
Если твердое тело является химическим соединением (например, NaCl), то число частиц в моле не равно постоянной Авогадро, а равно nNA, где n — число атомов в молекуле (для NaCl число частиц в моле равно 2NA, так, в одном моле NaCl содержится NA атомов Na и NA атомов Cl). Таким образом, молярная теплоемкость твердых химических соединений
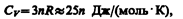
т. е. равна сумме атомных теплоемкостей элементов, составляющих это соединение.
Как показывают опытные данные (табл. 4), для многих веществ закон Дюлонга и Пти выполняется с довольно хорошим приближением, хотя некоторые вещества (С, Be, В) имеют значительные отклонения от вычисленных теплоемкостей. Кроме того, так же как и в случае газов (см. § 53), опыты по измерению теплоемкости твердых тел при низких температурах показали, что она зависит от температуры (рис. 113). Вблизи нуля кельвин теплоемкость тел пропорциональна Т3, и только при достаточно высоких температурах, характерных для каждого вещества, выполняется условие (73.1). Алмаз, например, имеет теплоемкость, равную 3R при1800 К! Однако для большинства твердых тел комнатная температура является уже достаточно высокой.
Таблица 4
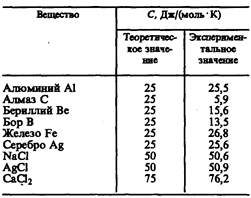
Расхождение опытных и теоретических значений теплоемкостей, вычисленных на основе классической теории, объяснили, исходя из квантовой теории теплоемкостей, А. Эйнштейн и П. Дебай.
§ 74. Испарение, сублимация, плавление и кристаллизация. Аморфные тела
Как в жидкостях, так и в твердых телах всегда имеется некоторое число молекул, энергия которых достаточна для преодоления притяжения к другим молекулам и которые способны оторваться от поверхности жидкости или твердого тела и перейти в окружающее их пространство. Этот процесс для жидкости называетсяиспарением(илипарообразованием), для твердых тел —сублимацией (иливозгонкой).
Испарение жидкостей идет при любой температуре, но его интенсивность с повышением температуры возрастает. Наряду с процессом испарения происходит компенсирующий его процесс конденсации пара в жидкость. Если число молекул, покидающих жидкость за единицу времени через единицу поверхности, равно числу молекул, переходящих из пара в жидкость, то наступает динамическое равновесие между процессами испарения и конденсации. Пар, находящийся в равновесии со своей жидкостью, называется насыщенным (см. также § 62).
Для большинства твердых тел процесс сублимации при обычных температурах незначителен и давление пара над поверхностью твердого тела мало; оно повышается с повышением температуры. Интенсивно сублимируют такие вещества, как нафталин, камфора, что обнаруживается по резкому, свойственному им запаху. Особенно интенсивно сублимация происходит в вакууме — этим пользуются для изготовления зеркал. Известный пример сублимации — превращение льда в пар — мокрое белье высыхает на морозе.
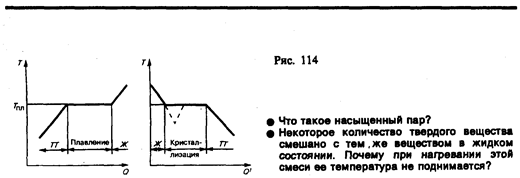
Если твердое тело нагревать, то его внутренняя энергия (складывается из энергии колебаний частиц в узлах решетки и энергии взаимодействия этих частиц) возрастает. При повышении температуры амплитуда колебаний частиц увеличивается до тех пор, пока кристаллическая решетка не разрушится, — твердое тело плавится. На рис. 114, а изображена примерная зависимость Т (Q), где Q — количество теплоты, получаемое телом при плавлении. По мере сообщения твердому телу теплоты его температура повышается, а при температуре плавления Tпл, начинается переход тела из твердого состояния в жидкое. Температура Tпл остается постоянной до тех пор, пока весь кристалл не расплавится, и только тогда температура жидкости вновь начнет повышаться.
Нагревание твердого тела до Tпл еще не переводит его в жидкое состояние, поскольку энергия частиц вещества должна быть достаточной для разрушения кристаллической решетки. В процессе плавления теплота, сообщаемая веществу, идет на совершение работы по разрушению кристаллической решетки, а поэтому Tпл = const до расплавления всего кристалла. Затем подводимая теплота пойдет опять-таки на увеличение энергии частиц жидкости и ее температура начнет повышаться. Количество теплоты, необходимое для расплавления 1 кг вещества, называется удельной теплотой плавления.

Если жидкость охлаждать, то процесс протекает в обратном направлении (рис. 114, б; Q' — количество теплоты, отдаваемое телом при кристаллизации): сначала температура жидкости понижается, затем при постоянной температуре, равной Tпл, начинаетсякристаллизация, после ее завершения температура кристалла начнет понижаться. Для кристаллизации вещества необходимо наличие так называемыхцентров кристаллизации — кристаллических зародышей, которыми могут быть не только кристаллики образующегося вещества, но и примеси, а также пыль, сажа и т. д. Отсутствие центров кристаллизации в чистой жидкости затрудняет образование микроскопических кристалликов, и вещество, оставаясь в жидком состоянии, охлаждается до температуры, меньшей температуры кристаллизации, при этом образуется переохлажденная жидкость (на рис. 114, б ей соответствует штриховая кривая). При сильном переохлаждении начинается спонтанное образование центров кристаллизации и вещество кристаллизуется довольно быстро.
Обычно переохлаждение расплава происходит от долей до десятков градусов, но для ряда веществ может достигать сотен градусов. Из-за большой вязкости сильно переохлажденные жидкости теряют текучесть, сохраняя, как в твердые тела, свою форму. Эти тела получили название аморфных твердых тел; к ним относятся смолы, мех, сургуч, стекло. Аморфные тела, являясь, таким образом, переохлажденными жидкостями, изотропны, т. е. их свойства во всех направлениях одинаковы; для них, как и для жидкостей, характерен ближний, порядок в расположении частиц; в них в отличие от жидкостей подвижность частиц довольно мала. Особенностью аморфных тел является отсутствие у них определенной точки плавления, т. е. невозможно указать определенную температуру, выше которой можно было бы констатировать жидкое состояние, а ниже — твердое. Из опыта известно, что в аморфных телах со временем может наблюдаться процесс кристаллизации, например в стекле появляются кристаллики; оно, теряя прозрачность, начинает мутнеть и превращаться в поликристаллическое тело.
В последнее время широкое распространение в народном хозяйстве получили полимеры — органические аморфные тела, молекулы которых состоят из большого числа одинаковых длинных молекулярных цепочек, соединенных химическими (валентными) связями. К полимерам относятся как естественные (крахмал, белок, каучук, клетчатка и др.), так и искусственные (пластмасса, резина, полистирол, лавсан, капрон и др.) органические вещества. Полимерам присущи прочность и эластичность; некоторые полимеры выдерживают растяжение, в 5—10 раз превышающее их первоначальную длину. Это объясняется тем, что длинные молекулярные цепочки могут при деформации либо сворачиваться в плотные клубки, либо вытягиваться в прямые линии. Эластичность полимеров проявляется только в определенном интервале температур, ниже которого они становятся твердыми и хрупкими, а выше — пластичными. Хотя синтетических полимерных материалов создано очень много (искусственные волокна, заменители кожи, строительные материалы, заменители металлов и др.), но теория полимеров до настоящего времени полностью не разработана. Ее развитие определяется запросами современной техники, требующей синтеза полимеров с заранее заданными свойствами.
§ 75. Фазовые переходы I и П рода
Фазой называется термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества. Если, например, в закрытом сосуде находится вода, то эта система является двухфазной: жидкая фаза — вода; газообразная фаза — смесь воздуха с водяными парами. Если в воду бросить кусочки льда, то эта система станет трехфазной, в которой лед является твердой фазой. Часто понятие «фаза» употребляется в смысле агрегатного состояния, однако надо учитывать, что оно шире, чем понятие «агрегатное состояние». В пределах одного агрегатного состояния вещество может находиться в нескольких фазах, отличающихся по своим свойствам, составу и строению (лед, например, встречается в пяти различных модификациях — фазах). Переход вещества из одной фазы в другую — фазовый переход — всегда связан с качественными изменениями свойств вещества. Примером фазового перехода могут служить изменения агрегатного состояния вещества или переходы, связанные с изменениями в составе, строении и свойствах вещества (например, переход кристаллического вещества из одной модификации в другую).
Различают фазовые переходы двух родов. Фазовый переход I рода (например, плавление, кристаллизация и т. д.) сопровождается поглощением или выделением теплоты, называемой теплотой фазового перехода. Фазовые переходы I рода характеризуются постоянством температуры, изменениями энтропии и объема. Объяснение этому можно дать следующим образом. Например, при плавлении телу нужно сообщить некоторое количество теплоты, чтобы вызвать разрушение кристаллической решетки. Подводимая при плавлении теплота идет не на нагрев тела, а на разрыв межатомных связей, поэтому плавление протекает при постоянной температуре. В подобных переходах — из более упорядоченного кристаллического состояния в менее упорядоченное жидкое состояние — степень беспорядка увеличивается, т. е., согласно второму началу термодинамики, этот процесс связан с возрастанием энтропии системы. Если переход происходит в обратном направлении (кристаллизация), то система теплоту выделяет.
Фазовые переходы, не связанные с поглощением или выделением теплоты и изменением объема, называются фазовыми переходами II рода. Эти переходы характеризуются постоянством объема и энтропии, но скачкообразным изменением теплоемкости. Общая трактовка фазовых переходов II рода предложена академиком Л. Д. Ландау (1908—1968). Согласно этой трактовке, фазовые переходы II рода связаны с изменением симметрии: выше точки перехода система, как правило, обладает более высокой симметрией, чем ниже точки перехода. Примерами фазовых переходов II рода являются: переход ферромагнитных веществ (железа, никеля) при определенных давлении в температуре в парамагнитное состояние; переход металлов и некоторых сплавов при температуре, близкой к 0 К, в сверхпроводящее состояние, характеризуемое скачкообразным уменьшением электрического сопротивления до нуля; превращение обыкновенного жидкого гелия (гелия I) при Т=2,9 К в другую жидкую модификацию (гелий II), обладающую свойствами сверхтекучести.
§ 76. Диаграмма состояния. Тройная точка
Если система является однокомпонентной, т. е. состоящей из химически однородного вещества или его соединения, то понятие фазы совпадает с понятием агрегатного состояния. Согласно § 60, одно и то же вещество в зависимости от соотношения между удвоенной средней энергией, приходящейся на одну степень свободы хаотического (теплового) движения молекул, и наименьшей потенциальной энергией взаимодействия молекул может находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном. Это соотношение, в свою очередь, определяется внешними условиями — температурой и давлением. Следовательно, фазовые превращения также определяются изменениями температуры и давления.
Дата добавления: 2017-04-20; просмотров: 544;
