Рассмотрим законы, описывающие поведение идеальных газов.
Заков Бойла — Мариотта *: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная:
pV — const при Т = const, m = const. (41.1)
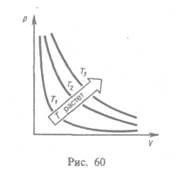
Кривая, изображающая зависимость между величинами р и V, характеризующими свойства вещества при постоянной температуре, называется иэотермой. Изотермы представляют собой гиперболы, расположенные на графике тем выше, чем выше температура, при которой происходит процесс (рис. 60).
Законы Гей-Люссака**: 1) объем данной массы газа при постоянном давлении изменяется линейно с температурой:
V=V0(1+аt) при р = const, m = const; (412)
2) давление данной массы газа при постоянном объеме изменяется линейно с температурой:
р = Ро (1+аt) при V = const, т = const. (41.3)
В этих уравнениях t — температура по шкале Цельсия, ро и Vo — давление и объем при 0°С, коэффициент а= 1/273,15 К-1.
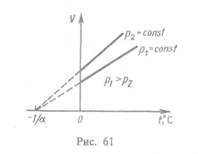
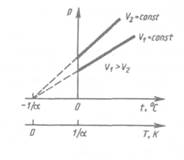
Процесс, протекающий при постоянном давлении, называется изобарным. На диаграмме в координатах V, t (рис. 61) этот процесс изображается прямой, называемой изобарой. Процесс, протекающий при постоянном объеме, называется нзохорным. На диаграмме в координатах р, t (рис. 62) он изображается прямой, называемой нзохорон.
Из (41.2) и (41.3) следует, что изобары и изохоры пересекают ось температур в точке t= -1/a=— 273,15 0С, определяемой из условия 1+аt=0. Если перенести начало отсчета в эту точку, то происходит переход к шкале Кельвина (рис. 62), откуда
Т = t + 1/а.
Вводя в формулы (41.2) и (41.3) термодинамическую температуру, законам Гей-Люссака можно придать более удобный вид:
V= Vо (1 + at) = Vo [1 + а (T- 1/а)] = Vo aT,
 ♦Р. Бойль (1627—1691) —английский ученый; Э. Мариотт (1620—1684) — французский физик.
♦Р. Бойль (1627—1691) —английский ученый; Э. Мариотт (1620—1684) — французский физик.
••Ж. Гей-Люссак (1778—1850) — французский ученый.

|
|
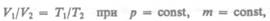 (41.4)
(41.4) 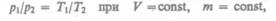 (41.5)
(41.5)
где индексы 1 и 2 относятся к произвольным состояниям, лежащим на одной изобаре или изохоре.
Закон Авогадро *: моли любых газов при одинаковых температуре и давлении занимают  одинаковые объемы. При нормальных условиях этот объем равен
одинаковые объемы. При нормальных условиях этот объем равен
По определению, в одном моле различных веществ содержится одно и то же число молекул, называемое постоянной Авогадро:
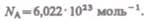
ЗаконДальтона**: давление смеси идеальных газов равно сумме парциальных давлений 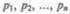 входящих в нее газов:
входящих в нее газов:
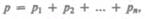
Парциальное давление— давление, которое производил бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при той же температуре.
§ 42. Уравнение Клапейрона — Менделеева
Как уже указывалось, состояние некоторой массы газа определяется тремя термодинамическими параметрами: давлением р, объемом V и температурой Т. Между этими параметрами существует определенная связь, называемая уравнением состояния, которое в общем виде дается выражением
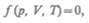
где каждая из переменных является функцией двух других.
Французский физик и инженер Б. Клапейрон (1799—1864) вывел уравнение состояния идеального газа, объединив законы Бойля — Мариотта и Гей-Люссака. Пусть некоторая масса газа занимает объем V1 имеет давление р1 ,и находится при температуре Т\. Эта же масса газа в другом произвольном состоянии характеризуется
 *А. Авогадро (1776—1856) — итальянский физик и химик. **Дж. Дальтон (1766—1844) — английский химик и физик.
*А. Авогадро (1776—1856) — итальянский физик и химик. **Дж. Дальтон (1766—1844) — английский химик и физик.


|
|
параметрами 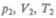 (рис. 63). Переход из состояния 1 в состояние 2 осуществляется
(рис. 63). Переход из состояния 1 в состояние 2 осуществляется
в виде двух процессов: 1) изотермического (изотерма 1 — 1,), 2) изохорного (изохора 1,-2).
В соответствии с законами Бойля — Мариотта (41.1) и Гей-Люссака (41.5) запишем:
 (42.1)
(42.1)
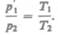 (42.2) Исключив из уравнений (42.1) и (42.2)
(42.2) Исключив из уравнений (42.1) и (42.2) 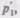 получим
получим
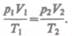
Так как состояния 1 и 2 были выбраны произвольно, то для данной массы газа величина pV/T остается постоянной, т. е.
pV/T = В = const. (42.3)
Выражение (42.3) является уравнением Клапейрона, в котором В — газовая постоянная, различная для разных газов.
Русский ученый Д. И. Менделеев (1834—1907) объединил уравнение Клапейрона с законом Авогадро, отнеся уравнение (42.3) к одному молю, использовав молярный объем Vm. Согласно закону Авогадро, при одинаковых р и Т моли всех газов занимают одинаковый молярный объем Vm, поэтому постоянная В будет одинаковой для всех газов. Эта общая для всех газов постоянная обозначается R и называется молярной газовой постоянной. Уравнению
pVm = RT (42.4)
Дата добавления: 2017-04-20; просмотров: 1350;
