Пирофосфатные электролиты
Для замены токсичных цианидных электролитов предложен ряд других, в числе которых дифосфатные, этилендиамидные, полиэтиленполиаминовые, аммиакатные и др.
Первый из них в настоящее время можно считать наиболее перспективным для производства. Затруднения при его применении связаны с двумя обстоятельствами: дефицитностью основного компонента – дифосфата калия и необходимостью особенно тщательного выполнения операций технологического процесса, предотвращения загрязнения электролита.
При смешивании растворов сульфатов меди и дифосфата калия образуется дифосфат меди Cu2P2O7, который растворяясь в избытке K4P2O7 дает комплексное соединение K2[Cu(P2O7)], или при большей концентрации растворяющего компонента K6[Cu(P2O7)2].
В зависимости от рН и концентрации свободных ионов 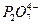 в растворе могут существовать в различных соотношениях ионы меди [CuP2O7]2- и [Cu(P2O7)2]6-, константы нестойкости которых, соответственно, равны 2·10-9 и 2·10-13.
в растворе могут существовать в различных соотношениях ионы меди [CuP2O7]2- и [Cu(P2O7)2]6-, константы нестойкости которых, соответственно, равны 2·10-9 и 2·10-13.
В щелочном растворе при рН > 8 и достаточном избытке свободных ионов 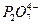 медь находится преимущественно в виде шестизарядных комплексных ионов [Сu(P2O7)2]6-, которые образуются в результате диссоциации:
медь находится преимущественно в виде шестизарядных комплексных ионов [Сu(P2O7)2]6-, которые образуются в результате диссоциации:
K6[Cu(P2O7)2]  6K+ + [Cu(P2O7)2]6- (12.д)
6K+ + [Cu(P2O7)2]6- (12.д)
При уменьшении рН возрастает относительная концентрация ионов [CuP2O7]2- вследствие взаимодействия [Cu(P2O7)2]6- с ионами водорода по реакции
[Cu(P2O7)2]6- + 4Н+  [CuP2O7]2- + H4P2O7 (12.е)
[CuP2O7]2- + H4P2O7 (12.е)
В слабокислых растворах при рН 5 – 7 и незначительном содержании свободных ионов 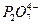 , наряду с ионами [Сu(P2O7)2]6- и [CuP2O7]2-, могут присутствовать комплексы [CuHP2O7]- и [CuH(P2O7)2]5-.
, наряду с ионами [Сu(P2O7)2]6- и [CuP2O7]2-, могут присутствовать комплексы [CuHP2O7]- и [CuH(P2O7)2]5-.
Выделение меди на катоде происходит преимущественно в результате восстановления двузарядных комплексов, образующихся вследствие диссоциации шестизарядных комплексов по реакциям:
[Cu(P2O7)2]6- 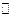 [CuP2O7]2- +
[CuP2O7]2- + 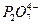 (12.ж)
(12.ж)
[CuP2O7]2- + 2  → Cu +
→ Cu + 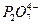 (12.з)
(12.з)
При высоком значении рН возможно прямое восстановление комплекса
[Cu(P2O7)2]6- + 2  = Cu + 2
= Cu + 2 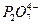 (12.и)
(12.и)
Разряд ионов меди характеризуется значительной поляризацией, которая возрастает с увеличением в растворе концентрации свободных ионов 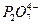 и значения рН. Поляризация обусловлена двумя факторами: пассивированием поверхности катода вследствие адсорбции
и значения рН. Поляризация обусловлена двумя факторами: пассивированием поверхности катода вследствие адсорбции 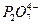 , образования фазовых пленок (Cu2O, Cu2P2O7) при низких плотностях тока и затруднением подвода к катоду разряжающихся комплексных анионов меди, которые возрастают с увеличением плотности тока.
, образования фазовых пленок (Cu2O, Cu2P2O7) при низких плотностях тока и затруднением подвода к катоду разряжающихся комплексных анионов меди, которые возрастают с увеличением плотности тока.
Для образования [Cu(P2O7)2]6- поддерживают соотношение концентраций Cu2+ : 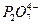 = 1 : (7 – 8).
= 1 : (7 – 8).
При оптимальном значении рН = 8,0 – 8,5 в дифосфатном электролите достигается максимальная концентрация комплексных ионов [Cu(P2O7)2]6-.
Анодный процесс в дифосфатных электролитах отличается образованием при определенных условиях на поверхности меди пассивирующей оксидной или солевой пленки, что может привести к снижению анодного выхода металла по току.
Для стабилизации анодного процесса в электролит добавляют сегнетовую соль, щавелевую, лимонную, триоксиглутаровую кислоту.
В промышленности используют дифосфатные электролиты следующих составов (г/л) и режимы электролиза:
1. 80 – 90 CuSO4·5H2O; 350 – 370 K4P2O7; 20 - 30 NH4NO3; pH ~ 8,3 – 8,7; t = 40 - 50°C, ik = 0,8 – 3 А/дм2
2. 30 – 65 Cu2P2O7·3H2O; 260 – 270 K4P2O7; 9 – 10 KH2PO4; 5 – 4 KNO3, аммиак (20%) до рН ~ 8,3 – 8,5; t = 50 - 55oС, ik = 1,5 – 5 А/дм2
3. 85 – 90 CuSO4·5H2O; 350 – 360 K4P2O7; 0,002 – 0,003 селенита натрия, рН ~ 8,3 – 8,7, t = 30 – 50oC, ik = 1 – 2 А/дм2.
Соотношение поверхностей катода и анода 1 : (2  3). Покрытия, полученные в электролите 1, малопористые и могут быть использованы для защиты стальных деталей от цементации, электролиты 2 и 3 предназначены для получения покрытий значительной толщины, в частности для гальванопластики.
3). Покрытия, полученные в электролите 1, малопористые и могут быть использованы для защиты стальных деталей от цементации, электролиты 2 и 3 предназначены для получения покрытий значительной толщины, в частности для гальванопластики.
С целью интенсификации процесса меднения при комнатной температуре и большего подавления реакции контактного обмена при осаждении покрытий на сталь в дифосфатный электролит вводят комплекс органических красителей.
Дата добавления: 2017-01-29; просмотров: 1720;
