ЭЛЕКТРОЛИТЫ И НЕЭЛЕКТРОЛИТЫ
Вещества, растворы и расплавы которых проводят электрический ток в растворах или расплавах, называют электролитами. Мы будем говорить только о веществах - электролитах, подразумевая их нахождение в растворах.
Вещества
 |  | ||
Электролиты Неэлектролиты
растворы солей, кислот сахар, бензин, бензол, хлороформ
оснований глицерин спирт, газы.
К ним относятся вещества с ионной и полярной ковалентной связью (KCl, NiSO4, HCl, H2SO4 , NaOH, Ba(OH)2 , KOH и др.). Сами электролиты еще делятся на сильные, слабые, средние электролиты. Особенно важна такая классификация для кислот. Если отнесение солей и оснований к сильным электролитам можно приблизительно сделать по растворимости, то для кислот необходимо рассмотрение многих факторов по составу, строению. Классификация электролитов по силе приведена таблице (приложение 1).
Сухие соли и основания, безводные кислоты электрический ток не проводят. Это говорит о том, что при растворении в воде такие вещества претерпевают серьезные изменения. Электропроводность растворов этих веществ объясняет теория электролитической диссоциации, начала которой положил Сванте Август Аррениус в 1887 году.
II. ДИССОЦИАЦИЯ ЭЛЕКТРОЛИТОВ. ОКРАСКА ИНДИКАТОРОВ В РАЗЛИЧНЫХ СРЕДАХ
Процесс распада веществ электролитов на ионы пол действием растворителя или в расплаве называется электролитической диссоциацией.
Это обратимый процесс и обозначается стрелочками обратимости *:
ионизация
 Na Cl → Na+ + Cl-
Na Cl → Na+ + Cl-

моляризация
Сколько молекул распадается на ионы, столько молекул и образуется.
* некоторые авторы процессы диссоциации сильных электролитов изображают стрелкой, направленной вперед, а слабых электролитов - обратимыми стредками. Однако, это только символ в помощь для графического различия процессов у разных по природе веществ.
Основные положения ТЭД
1. Электролиты при растворении в воде диссоциируют на ионы: катионы и анионы. Количество катионов и анионов может быть различным, но суммарный заряд всех катионов всегда равен суммарному заряду всех анионов, поэтому, весь раствор в целом остается электрически нейтральным.
Ионы – это атомы или группы атомов, имеющие положительный или отрицательный заряд.
Простые ионы: Сl-, F-, S2-, Na+, Mg2+ и др.
Сложные ионы: PO43-, NH4+, SO42- и др.
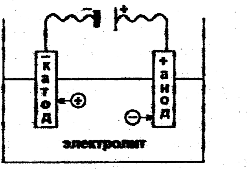
2. При пропускании электрического тока через раствор электролита ионы приобретают направленное движение: катионы движутся к отрицательно заряженному катоду, а анионы к положительно заряженному аноду.
 В обычных условиях ионы (без тока) совершают беспорядочное движение:
В обычных условиях ионы (без тока) совершают беспорядочное движение:
 К(-) А (+)
К(-) А (+)

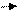



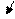

 + __ + + + + + __
+ __ + + + + + __

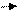



 __ + __ __ + + __ __
__ + __ __ + + __ __
 __
__
 |




 . + __ + + __ __
. + __ + + __ __
а) б)
в)
Рис. 1. Хаотическое движение ионов (электрический ток
отсутствует) а); направленное движение ионов в растворе
электролита под действием электрического тока б), в).
3. Диссоциация – это обратимый процесс, поэтому с течением времени наступает химическое равновесие. При этом число молекул распавшихся на ионы (диссоциация) равно числу вновь образовавшихся из ионов.
7 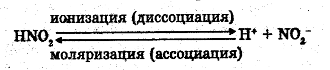
Свойства ионов отличаются от свойств соответствующих атомов, так как строение их различно, например атом хлора (простое вещество – хлор Сl2) и ион Сl- (хлорид-анион):
+17 Сl ) ) ) +17 Сl - ) ) )
2 8 7 2 8 8
Хлор – газ, молекула которого состоит из двух атомов хлора ядовит, сильный окислитель, анион хлора входит в состав поваренной соли, поступает в организм с пищей, не ядовит, в реакциях может быть только восстановителем.
Механизм диссоциации
В основе механизма диссоциации лежит гидратная теория растворов Д.И.Менделеева, развитая И.А.Каблуковым. Основную роль при диссоциации электролитов в растворах воды играет полярное строение молекул воды:

 О _
О _


 диполь
диполь
 Н Н +
Н Н +
При растворении вещества с ионной связью в воде полярные молекулы воды ориентируются вокруг ионов вещества:
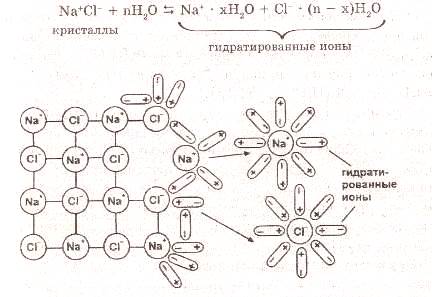
Рис. 2. Схема электролитической диссоциации электролита
с ионной связью (хлорида натрия) в водном растворе.
Возникают силы взаимодействия между ионами веществ и молекуляами воды.В результате ослабевает притяжение между ионами в электролите в 81 раз (для растворителя – воды). Электролит распадается на гидратированные ионы, то есть, окруженные молекулами воды.
При диссоциации кислот происходит не просто распад на ионы, а каждый катион водорода удерживает молекулу воды и образуется гидрат постоянного состава. Такой гидратированный протон изображают:
Н+ + Н2О = Н3О+
ион гидроксония
Процесс электролитической диссоциации хлороводорода (вещество с полярной ковалентной связью) с учетом гидратации можно представить так:
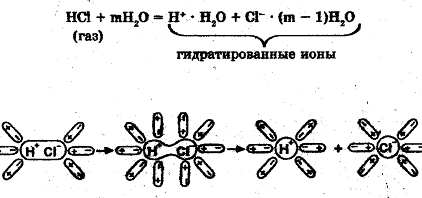
Рис. 3. Схема электролитической диссоциации электролита с полярной
ковалентной связью (хлороводорода) в водном растворе.
При растворении в воде происходит ориентация диполей воды и возникают междипольные связи. В результате диполь-дипольного взаимодействия изменяется характер химической связи в молекуле НCl. Связь «дополяризуется» и затем становится ионной. Она легко разрывается с образованием гидратированных ионов.
В образовании гидратированных ионов большую роль играют донорно-акцепторныое, диполь-дипольное и ион-дипольное взамодействия, водородные связи.
Роль донорно-акцепторного взаимодействия (см. раздел 5) в образовании, например, иона H3О+ можно показать следующей схемой:
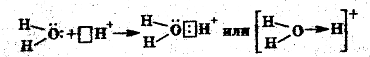
Диссоциация кислот
Кислотами называются электролиты, которые в водных растворах диссоциируют с образованием только одного вида катионов – катионов водорода.
HNO3 ßà H+ + NO3 - (нитрат-анион)
HCl ßà H+ + Cl- (хлорид-анион)
Многоосновные кислоты диссоциируют ступенчато:
H2SO4 ßà H+ + HSO4- (гидросульфат-ион)
HSO4- ßà H+ + SO42- (сульфат-анион)
Легче диссоциация протекает по 1-ой ступени, по 2- ой и 3-ей ступени диссоциация протекает очень трудно, так как положительная частица отрывается от отрицательно-заряженной частицы, которая хорошо притягивает катион водорода.
H 3PO4 ßà H+ + H 2 РO4 - (дигидрофосфат-анион)
H 2 РO4 - ß à H+ + H РO4 2- (гидрофосфат-анион)
H РO4 2- ßà H+ + РO4 3- (фосфат-анион)
Диссоциация оснований
Основания – Это электролиты, которые в водных растворах диссоциируют с образованием только одного вида анионов - гидроксид - анионов. Их принято называть гидроксидами, хотя кислородосодержащие кислоты тоже относятся к гидроксидам (кислотным).
NaOH ßà Na+ + OH—
Многокислотные основания диссоциируют ступенчато:
Са(ОН)2 ßà СаОН+ + ОН-
СаOH+ ßà Ca2+ + OH-
катион гидроксокальция
или гидроксокатион кальция
Диссоциация амфотерных гидроксидов
Диссоциируют очень слабо двояко: и как основания и как кислоты
а) в кислой среде, как основания:
Zn(ОН)2 ßà Zn2+ + 2ОН- (суммарно) или
Zn(ОН)2 ßà ZnОН+ + ОН-
ZnOH + ßà Zn2+ + OH-
катион гидроксоцинка
или гидроксокатион цинка
б) в щелочной среде: Zn(ОН)2 ß à2H+ + ZnO 22- (суммарно) или
Zn(OH)2 ß à H+ + HZnO2— гидроксоцинкат-анион
HZnO2— ßà H+ + ZnO22- цинкат-анион
Диссоциация солей
Средние соли – это электролиты, которые в водных растворах диссоциируют на катионы металла (или аммония) и кислотный остаток.
CaCl2 ßà Ca2+ + Cl-
хлорид кальция
Na2SO4 ßà 2Na+ + SO42—
сульфат натрия
Кислые соли – диссоциируют на катионы металла и кислотный остаток, содержащий в своем составе водород.
В небольшой степени этот водород также отщепляется в виде катиона.
NaHCO3 ßà Na+ + HCO3—
гидрокарбонат натрия
Основные соли – диссоциируют на кислотный остаток и катион, содержащий гидроксо-группу.
CaOHCl ßà CaOH+ + Cl-
гидроксохлорид кальция
(ZnOH)2SO4 ßà 2 ZnOH+ + SO42-
гидроксосульфат цинка
В небольшой степени гидроксо-группа также отщепляется в виде аниона.
Окраска индикаторов
| Название индикатора | Кислая среда | Нейтральная среда | Щелочная среда |
| Универсальный | Красный | Желтый | Синий |
| Лакмус | Красный | Фиолетовый | Синий |
| Синий лакмус | Красный (изменяет окраску) | Синий (не изменяет окраску) | Синий (не изменяет окраску) |
| Красный лакмус | Красный (не изменяет окраску) | Красный (не изменяет окраску) | Синий |
| Метиловый красный | Красный | Красный | Желтый |
| Метиловый оранжевый | Розовый (красный) | Оранжевый (желтый) | Желтый |
| Фенолфталеиновый | Бесцветный | Бесцветный | Малиновый |
| Тимоловый фталеиновый | Бесцветный | Бесцветный | Синий |
III. СТЕПЕНЬ ДИССОЦИАЦИИ. КОНСТАНТА ДИССОЦИАЦИИ.
Количественными характеристиками силы электролитов являются степень диссоциации и константа диссоциации.
Степень диссоциация
Степень диссоциации - это отношение числа молекул, распавшихся на ионы к общему числу растворенных молекул электролита. Выражается в долях и в процентах.
с1
 a = ∙ 100 %
a = ∙ 100 %
с
a – степень диссоциации
с1 – концентрация молекул электролита, распавшегося на ионы;
с – общая концентрация молекул электролита.
Например, из 0,05 моль H2SO3, растворенных в воде, на ионы распалось 0,01 моль. Найти степень диссоциации H2SO3.
0,01
 a = ∙ 100% = 20 %
a = ∙ 100% = 20 %
0,05
Это означает, что из 100 молекул сернистой кислоты на ионы распалось только 20.
Степень диссоциации зависит:
1) от природы растворителя; например, СоCl2 – синего цвета, а гидратированные ионы Со2+ - розового цвета. Если хлорид кобальта растворить в воде, то раствор становится розовым, образуется много ионов. Большинство молекул распались на ионы. Если растворить эту же соль в спирте, то раствор имеет синий цвет, т.к. в растворе в основном находятся молекулы. При растворении в воде сила притяжения в между ионами Со2+ и Сl- ослабевает в 81 раз по сравнению с вакуумом, а в спирте, - только в 27,8 раз. Поэтому в воде больше молекул распадаются на ионы. Таким образом, чем больше диэлектриическая проницаемость - ε (величина постоянная) растворителя, тем больше степень диссоциации электролита в нем;
2) от концентрации (разбавления раствора)
разб. р-р
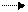
 СuСl2 Cu2+ + 2Cl—
СuСl2 Cu2+ + 2Cl—
зеленый конц. р-р голубой р-р
При разбавлении равновесие сместилось вправо, т.к. при разбавлении увеличилось число катионов, а гидратированные катионы меди (+2) окрашены в голубой цвет.
Таким образом, чем больше концентрация, тем меньше степень диссоциации, а чем меньше концентрация, тем больше степень диссоциации.
3) от природы электролита: цинк реагирует с равными объемами кислот одинаковой концентрации, а реакция идет с разными скоростями:
Zn + 2 HCl = ZnCl2 + H2↑
соляная кислота
(сильная)
Zn + 2CН3COOH = (CH3COO)2 Zn + H2 ↑
уксусная кислота
(слабая)
Реакция с соляной кислотой протекает бурно и быстрее, чем с уксусной
кислотой, так как последняя образует меньще ионов при диссоциации, чем
соляная кислота.
4) от добавления к раствору первого электролита электролита № 2 с одноименным ионом первому электролиту; степень диссоциации 1-го электролита уменьшается.
Опыт:
В пробирку нальем 1 мл раствора воды и добавим по 2 капли растворов NH4OH и фенолфталеина. Раствор окрасится в малиновый цвет (среда
щелочная). Затем добавим электролит с одноименным ионом NH4Cl – хлорид аммония (содержит катион аммония NH4+), при этом раствор обесцвечивается:
 NH4OH ßà NH4+ + OH—
NH4OH ßà NH4+ + OH—
 создает щелочную среду
создает щелочную среду
NH4Clßà NH4+ + Cl—
C увеличением числа одноименных ионов NH4+ при добавлении хлорида аммония равновесие смещается влево ( по принципу Ле Шателье), так как катионы аммония связывают почти все гидроксид-ионы в молекулы NH4OH и ранее малиновый раствор обесцвечивается.
5) от температуры: при ее повышении степень диссоциации увеличивается для слабых электролитов (эндотермическая реакция);
6) от числа атомов кислорода в молекуле кислородосодержащих кислот: чем больше атомов кислорода в молекуле кислот, тем больше степень ее диссоциации;
например HСlO -хлорноватистая кислота практически не распадается на
ионы, она слабее угольной(<0,17 %);
сравните:
n HСlO3 (хлорноватая) a =90 %
n HClO4 (Хлорная) a = 95 %
7) от радиуса аниона (поляризуемости) в безкислородных кислотах:
сила кислот увеличивается в ряду: HF HCl HBr HI;
связь Н – Гал ослабевает, так как радиус и поляризуемость йодид-аниона
увеличиваются.
По силе электролиты разделяются на:
1) сильные: (d> 30%) Все растворы солей кроме роданида железа(Ш), хлорида
ртути(П), хлората ртути (П).
Кислоты: соляная – 98%; серная – 58%; азотная – 91%; бромоводородная – 92%;
Основания: КОН –84%; NaОН - 84%; Ва(ОН)2 – 92 %
2) средней силы: a= 2-30%
фосфорная кислота –26%; азотистая – 6,5%; H2F2 –8.5%
3) слабые a < 2 5: уксусная кислота – 1,3 %; гидроксид аммония –
1,3 %; угольная кислота –0,17 %; сероводородная –0,07 %;
HCN- 0,01% .
К ним относятся также основания не щелочных и не щелочноземельных металлов. Примеры приведены в таблице (приложение 1).
Константа диссоциации
Процесс диссоциации обратимый, и с течением времени устанавливается
химическое равновесие:
CH3COOH ßà H+ + CH3COO—
уксусная кислота ацетат-анион
Применив к нему закон действующих (действия) масс, получим:
[H+] [CH3COO-]
K дисс. = --------------------------------- === 1,86 . 10—5
[ CH3COOH]
•Закон действующих масс для слабых электролитов и газов в реакциях
говорит о том, что скорость реакции равно произведению равновесных концентраций веществ, взятых в степенях, равных их стехиометрическим коэффициентам.
Например,
Aa + Bb ßà Dd + Ff
В момент равновесия скорости прямой и обратной реакций будут равны:
V прямой реакции = V обратной реакции
→ ←
k ∙[A] a∙ [B] b = k ∙ [D] d ∙ [F] f
Тогда из математической пропорции можно записать:
→
k [D] d ∙ [F] f

 = = K равновесия
= = K равновесия
→
k [A] a∙ [B] b
K равновесия - константа равновесия. В случае диссоциации электролитов она называется константой диссоциации (К.Д.Э.)
К.Д.Э. – это отношение произведения концентрации ионов к концентрации недиссоциированных молекул слабого электролита, взятых в степенях, равных стехиометрическим коэффициентам в уравнении диссоциации.
По ее величине можно судить о силе электролита. Чем больше константа диссоциации, тем больше концентрация ионов и сильнее электролит.
Константа диссоциации зависит от тех же факторов, что и степень диссоциации.
IV. ДИССОЦИАЦИЯ ВОДЫ. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ВЕЛИЧИНА рН (ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ).
Вода - очень слабый электролит и диссоциирует на ионы в незначительной степени:
2Н2О ßà H3O+3 + OH- или
НОН ßà H+ + OH—
[H+] ∙ [ OH--]
 K дисс = = 1,8 • 10—16
K дисс = = 1,8 • 10—16
[ HOH]
Константа равновесия или диссоциации воды очень незначительна, тогда концентрацию недиссоциированных молекул воды можно принять за величину постоянную и равную для объема воды равного одному литру (1 л):
m (H2O) 1000г

 [HOH] = = = 55,5 моль\л
[HOH] = = = 55,5 моль\л
M (HOH) 18 г\моль
Это значение велико по сравнению с Кдисс.
Умножим левую и правую часть выражения для константы диссоциации на [HOH], тогда произведение Кдисс.∙ [HOH] = [H+]∙ [OH-] = 1,8 • 10—16 ∙ 55,5 = 10—14
Кдисс.∙ [HOH] - ионное произведение воды - Кw
Кw = [H+] ∙ [OH-] = 10—14 - величина постоянная.
Отсюда следует: как бы не изменялась концентрация водородных и гидроксильных ионов в воде или в разбавленном водном растворе слабого электролита, их произведение всегда равно ионному произведению воды.
Так как [H+] = [OH-] в воде, то [H+] ∙ [OH-] = [ H+] 2 = [OH-] 2 = 10—14 ,
 |
 тогда [H+] = [OH-] = Кw = 10—14 = 10—7 ,
тогда [H+] = [OH-] = Кw = 10—14 = 10—7 ,
Если к чистой воде добавить кислоты, то увеличится концентрация ионов Н+; допустим концентрация увеличилась от 10—7 до 10-4 , тогда
Кw 10-14

 [ OH-] = = = 10-10
[ OH-] = = = 10-10
[H+] 10—4
Если к чистой воде добавить щелочи. То увеличится концентрация ионов ОН- допустим от 10-7 до 10-3, тогда
Кw 10-14

 [ H+] = = = 10-11
[ H+] = = = 10-11
[ОH-] 10—3
Таким образом, в водных растворах с различной средой (кислотной, нейтральной, щелочной) всегда присутствуют ионы Н+ и ОН—
В нейтральной среде: [H+]=[OH-]= 10-7
В кислой среде: [H+] > 10-7 (например, 10-5, 10-3 , 10-1)
В щелочной среде: [H+] < 10-7 (например, 10-9, 10-11 , 10-13)
Концентрация ионов водорода выражается очень малыми величинами и пользоваться ими при расчете неудобно. Более удобная форма выражение концентраций через водородный показатель, который численно равен отрицательному логарифму концентрации водородных ионов:
рН = - lg [H+]
Отсюда рН = lg [H+] = -lg 10—7 = 7 (нейтральная среда)
рН = -lg 10—5 = 5 (кислая среда)
рН = -lg 10—10 = 10 (щелочная среда)
Для упрощенного расчета рН необходимо выполнить следующий алгоритм действий:
1) -пусть [Н+] = 10-6, тогда рН равен степени с противоположным
знаком, т.е. 6;
-пусть [Н+] = 10-4,7, тогда рН равен 4,7;
2) -пусть известна [OH-], тогда рН равен: 14 минус показатель степени
концентрации этих ионов; например, [ОН-] = 10-4,, тогда рН равен
14 – 4 = 10;
Шкала значений водородного показателя и концентрации катионов водорода
рН 1 2 3 4 5 6 7 8 9 10 11 12 13 14
[H+]10-1 10-2 10-3 10-4 10-5 10-6 10-7 10- 8 10-9 10-10 10-11 10-12 10-13 10-14


 сильно-кислая слабо-щелочная
сильно-кислая слабо-щелочная
слабо-кислая сильно-щелочная

 увеличение кислотности увеличение щелочности
увеличение кислотности увеличение щелочности
нейтральная
V. ПРОТОЛИТИЧЕСКАЯ ТЕОРИЯ БРЕНСТЕДА-ЛОУРИ
Протолитическая теория кислот и оснований, предложена в 1923 году датским ученым Бренстедом и английским ученым Лоури.
Согласно этой теории: кислотами (основаниями) являются вещества, молекулы или ионы, которые отдают (соотвественно, присоединяют) протоны. Как те, так и другие получили название протолитов. Под протоном понимают положительный ион водорода (катион водорода Н+).
Реакции отщепления протонов изображаются уравнением:
кислотаßà основание + Н+
Например:
HCl ßà + H+ + Cl-
где Сl- - основание, сопряженное кислоте HCl.
Свободные протоны в растворах самостоятельно не существуют. Они переходят от кислоты к какому-либо основанию, поэтому в растворе всегда протекают два процесса:
CH3COOH ßà CH3COO-- + H+
к-та 1 осн-ие 1
NH3 + H+ ßà NH4+
осн-ие 2 к-та 2
Равновесие между ними изображают:
кислота 1 + основание 2 ßà Основание 1 + кислота 2

 СH3COOH + NH3 CH3COO- + NH4+
СH3COOH + NH3 CH3COO- + NH4+
 |
сопряженные кислота и сопряженные кислота и
основание №1 основание № 2
Таким образом, из кислоты и основания всегда получаются новые сопряженные кислота и основание. Теория расширила круг кислот и оснований – ими могут быть ионы. Одно и то же вещество в зависимости от того, с чем оно реагирует, может быть либо кислотой или основанием.
Льюис предложил общее определение:
кислота – это вещество, которое акцептирует электронную пару;
основание - это вещество, которое предоставляет электронную пару. Исходя из этого определения, взаимодействие между кислотами и основаниями сводится к формированию ковалентной связи по донорно-акцепторному механизму:
: NH3 + H+ à NH4+
Из представлений Бренстеда-Лоури вода обладает амфотерными свойствами, так как способна отдавать и присоединять протоны. В присутствии более
сильных оснований вода ведет себя как кислота, а в присутствии более сильных кислот, как основание:
H2O + NH3 ßà NH4+ + OH—
к-та осн..
HCl + H2O ßà H3O+ + Cl--
к-та осн.
Теория вскрыла относительность понятий о кислотах и основаниях и показала, что продукты их взаимодействия следует рассматривать как новые кислоты и основания.
VI. РЕАКЦИИ ОБМЕНА В ВОДНЫХ РАСТВОРАХ ЭЛЕКТРОЛИТОВ. ИОННЫЕ РЕАКЦИИ И УРАВНЕНИЯ
Электролиты в водных растворах находятся в виде ионов или частично в виде ионов (сильные электролиты) , а в основном в виде молекул (слабые электролиты). Реакции между водными растворами электролитов – это реакции, в которых участвуют ионы. Такие реакции называются ионными. Реакции такого типа возможны, если ионы одного вещества взаимодействуют с ионами другого вещества, связываются между собой и образуют:
А) нерастворимое вещество (осадок, в уравнении обозначают ↓)
Б) газообразное вещество (в уравнении обозначают ↑)
В) малодиссоциирующее вещество (слабый электролит, например, вода)
Г) комплексные соединения
Если в реакциях химические элементы не изменяют степени окисления, то реакции называются реакциями ионного обмена. Реакции будут необратимы и протекают до конца, если выполняются условия, обозначенные в пунктах а,б,в,г.
Случай 1. Реакция обмена с образованием осадка, например, между ортофосфорной кислотой и нитратом серебра:
Запишем уравнение реакции в молекулярной, полной ионной и сокращенной ионной форме:
1) молекулярная форма:
H3PO4 + 3AgNO3 à Ag3PO4 ¯ + 3НNO3
19 2) переписываем уравнение, изобразив хорошо диссоциирующие вещества в виде ионов, а уходящие из сферы реакции – в виде молекул:
3H+ + PO4 3- + 3Ag+ + 3NO3 -à Ag3PO4 ¯ + 3Н+ + 3NO3+
- это полное ионное уравнение;
3) исключаем из обеих частей равенства одинаковые ионы, т.е. ионы, не участвующие в образовании малодиссоциирующего вещества:
3H+ + PO4 3- + 3Ag+ + 3NO3 -à Ag3PO4 ¯ + 3Н+ + 3NO3-
 |  |
4) выписываем оставшиеся ионы, участвующие в образовании малодиссоциирующего вещества:
3Ag+ + PO4 3- à Ag3PO4↓
- это сокращенное ионное уравнение
Случай 2. Реакция обмена с образованием газообразного вещества, например, между хлоридом аммония и известковой водой (гидроксидом кальция):
1) 2 NH4Cl + Ca(OH)2 à CaCl2 + 2 NH3↑ + 2 H2O
2) 2 NH4+ + 2 Cl - + Ca2+ + 2OH- à Ca2+ +2 Cl- + 2 NH3↑ + 2 H2O


 3) 2 NH4+ + 2 Cl - + Ca2+ + 2OH- à Ca2+ +2 Cl- + 2 NH3↑ + 2 H2O
3) 2 NH4+ + 2 Cl - + Ca2+ + 2OH- à Ca2+ +2 Cl- + 2 NH3↑ + 2 H2O
4) 2 NH4+ + 2OH- à 2 NH3↑ + 2 H2O
Случай 3. Реакция обмена с образованием воды (реакция нейтрализации):
1) NaOH + HCl à NaCl + H2O
2) Na+ + OH- + H+ + Cl- à Na+ + Cl- + H2O
 |  |  |  | ||||
3) Na+ + OH- + H+ + Cl- à Na+ + Cl- + H2O
4) H+ + OH- à H2O
Случай 4. Реакция с образованием комплексных ионов:
1) 2AgNO3 + 6NH3 +2 Н2O = 2[Ag(NH3)2]OH + 2NH 4NO3
Диамминсеребра (I)
гидроксид
2) 2Ag++ 2NO3 - + 6NH3 +2 Н2O = 2[Ag(NH3)2]+ + 2OH- + 2NH4+ + 2 NO3 -
 3) 2Ag++ 2NO3 - + 6NH3 +2 Н2O = 2[Ag(NH3)2]+ + 2OH- + 2NH4+ + 2 NO3 -
3) 2Ag++ 2NO3 - + 6NH3 +2 Н2O = 2[Ag(NH3)2]+ + 2OH- + 2NH4+ + 2 NO3 -
4) 2Ag++ 6NH3 +2 Н2O = 2[Ag(NH3)2]+ + 2OH- + 2NH4+
При невыполнении таких условий реакции являются обратимыми и не протекают до конца, так как ионы не связываются и не выводятся из сферы реакции.
VII. ГИДРОЛИЗ СОЛЕЙ
Гидролиз соли – взаимодействие ионов соли и воды, приводящее к образованию слабого электролита.
Причина гидролиза – образование слабого электролита, следствие – в более частых случаях изменение рН среды.
«Hydro” – вода
«Lysis” – разложение.
Для того, чтобы определить подвергается соль гидролизу или нет необходимознатькакие основания и кислоты образуют данную соль в реакциях нейтрализации: сильные или слабые электролиты.
Типы гидролиза
1. Гидролиз по аниону(соль образована катионами сильных оснований и анионами слабых кислот);
2. Гидролиз по катиону(соль образована катионами слабых оснований и анионами сильных кислот);
3. Гидролиз смешанный – по катиону и аниону(соль образована катионами слабых оснований и анионами слабых кислот);
4. Соль гидролизу не подвергается, если образована катионами и анионами сильных электролитов.
Чтобы написать уравнения гидролиза, нужно рассмотреть из каких по силе электролитов (кислоты и щелочи) может быть получена данная соль, например,
сульфит бромид нитрит хлорид
натрия цинка аммония натрия

 Na2SO3 ZnBr2 NH4NO2 NaCl
Na2SO3 ZnBr2 NH4NO2 NaCl
 | |||||||||||
 |  | ||||||||||
 | |||||||||||
 | |||||||||||
 | |||||||||||
NaOH H2SO3; Zn(OH)2 HBr ; NH4OH HNO2 NaOH HCl
сильный слабый слабый ильный слабый слабый сильный сильный
(по аниону) (по катиону) (смешанный)
 подвергаются гидролизу не подвергается
подвергаются гидролизу не подвергается
Дата добавления: 2016-05-16; просмотров: 3038;
