Атомдық және иондық радиустар
Атом ядросының оң заряді мен оның сыртындағы электрондардың теріс заряді тең болатыны белгілі. Егер олардың зарядтары тең болмаса, онда атом зарядталған болады. Зарядталған атомды ион дейді. Теріс заряды артық ионды анион деп, оң заряды артық болса катион деп атайды.
Екіион арасындағы тарту күші мен тебу күші теңгерілгенде ғана тұрақты берік кристалдар құрылады. Бұл екі күштің теңгерілуінің өлшем бірлігі екі ионның центр арасындағы ара-қашықтығы болады.
Кристалдар құраушы атомдар мен иондардың өз ара әсер күштері бірдей емес, сондықтан ара қашықтығы да бірдей емес, олай болса олардың струк-турасы да бірдей болмайды.
Ара-қашықтықты табу үшін әрбір атомның не ионның айналасында өзі әсер ететін меншікті өрісі бар деп есептелінеді. Минералдар көбінесе иондық қосылыстар болып келеді, сондықтан олар иондық радиус өлшемі қол-данылады.
Иондық радиус шамасы оның валенттігімен байланысты, Аниондар катиондардан гөрі ірілеу болады, мысалы Сl1-–1,81 А0, F1–0,83 А0, О2 –1,32 А0 катиондар Mg2+–0,78А0, Fe3+–0,67А0. Валенттілік артқанда радиус шамасы кішірейеді: Fe2+ – 0,83 А0, Fe3+ – 0,67 А0, Si4 – 0,39 А0.
Кристалдағы атом аралық байланыс күштері. Химиялық байланыс әрекеттесуші екі элемент атомдары ядроларының арасындағы сыртқы орби-тальдардағы электрондардың қозғалысынан туады.
Минералдарда байланыстардың барлық түрі – иондық, коваленттік, металдық, молекулалық (ван-дер-ваальстік), донорлық-аксепторлық– болатыны анықталған.
Иондық байланыс қарама-қарсы зарядталған иондардың тарту күштерінің әсерінен туады. Металдық қасиеті бар атомдар электрондарын береді, ол метал емес қасиеті бар атомдар (металоидтар) электрондарды қабылдайды.
Коваленттік немесе гомополюстік байланысты әрекеттесетін атомдар-дың ядролары сыртқы орбитальдағы электрондарын ортақ пайдаланады.
Металдық байланыс оң заряты иондар арасында біріккен электрондардың (еркін ауысып) қозғалуымен байланысты.
Молекулалық байланыс тарту күші әлсіз молекулалар арасында орнайды.
Донорлық-аксепторлық байланыста бір атомның өзара берік байланыс-тағы екі электронын басқа атом пайдаланады, сөйтіп электрондар екі атомға да ортақ болады.
Бір минералдың өзінде бір немесе бірнеше байланыстар болуы мүмкін. Мысалы, алмазда (С) коваленттік және молекулалық байланыс бар. Талькте – Mg3[Si4O10][OH]2 –аниондық топтағы [Si4O10]4- иондары коваленттік байлан-ысты, Mg2+ иондық байланыс құрайды, ал Mg3[Si4O10] қабаттары молекулалық байланыс құрайды.
Кендерді пайдалану мақсатымен қолданылатын процестердің тиімділік-теріне оның ішіндегі бағалы минералдарды тау жыныстарынан және өзара бөлуде оларды құрайтын атомдар арасындағы байланыс түрлерінің маңыз-дылығы өте зор. Кен байытуда ең жиі қолданылатын байыту әдісі – флотациялық әдіс. Ол әдіс минералдардың сумен әрекеттесуі не әрекеттес-пеуіне негізделген. Сондықтан атом аралық байланыстарды өте жақсы білу қажет. Осы жай металлургиялық өңдеу әдістерінеде тікелей қатысты.
Координациялық сан. Кристалдық торды құраушы кез келген атомның немесе ионның айналасында бірдей қашықтықта ең таяу орналасқан атомдар мен иондардың санын координациялық сан деп атайды. Мысалы, кремнийоттек тетраэдрінде [SiO4]4- кремнийдің бір ионын [Si4+] оның айнала-сында тетраэдр бұрыштарында орналасқан оттектің 4 ионы O2- қоршаған, демек кремнийдің координациялық саны 4-ке тең.
Полярлану қасиеттері. Сыртқы электр өрісінің әсерінен иондық сфера-ның (қабықтың) пішінінің өзгеріп деформацияға ұшырауы полярлану деп аталады. Иондық радиусы неғұрлым үлкен, заряды неғұрлым аз болса оның полярлануы күшті болады. Полярлану қасиеттері көбінесе аниондарда байқалады.
Изоморфизм. Грекше “изо”–бірдей, “морфе” – пішін, демек тең формалық деген мағына береді. Валенттілігі, полярлану күші, иондық радиустары бірдей атомдардың (иондардың) кристалдық торды бұзбай бірінің орнын екіншісі алғандағы кристалдық заттың химиялық құрамының өзгеруін изоморфизм деп атайды. Изоморфизм нәтижесінде химиялық элементер кристалдар мен минералдарда бірін бірі алмастыру арқылы аралас қосылыстар береді. Соның нәтижесінде түзілетін қосылыстардың қасиеті ақырындап үздіксіз өзгереді.
Полиморфизм (грекше “поли”–көп, “морфос” – пішін). Химиялық құрамы бірдей заттардың әр түрлі құрылым құрауын полиморфизм деп атайды. Осыған ең көрнекті мысал ретінде алмазбен графитті алуға болады. Екеуіде көміртектен (С) тұрады, бірақ құрылымы әртүрлі. Алмаздың координациялық саны 4, графиттікі–3. Алмаз– мөлдір, жарқырауық, ең қатты зат. Графит – қара, сұр түсті, күйе тәрізді қолға жұғатын ең жұмсақ зат. Мұның себебі мынадай: алмаздағы көміртек атомдары коваленттік байланысты, ал графиттің қабаттардағы көміртек атомдары коваленттік байланыста болса, ал қабаттар бір-бірімен әлсіз молекулалық байланыста болады. Алмазбен графиттің осындай қасиеттері болуы олардың әртүрлі қысымда және температурада пайда болулары.
Кристалдық энергия. Иондар қосылып кристалдық тор құрған уақытта олардан белгілі мөлшерде энергия бөлініп шығады. Кристалдық энергиясы деп осыны атайды. Кристалдық құрылыстың беріктігі мен қасиеттерін және жаратылысын айыру үшін осы кристалдану энергиясын есептеп шығару керек. Оны есептеу әдісі Кулон заңына негізделген.
Әрбір ионның өзіне тән энергиясы болады. Иондар бір-бірімен әрекеттесіп қосылғанда оның энергиясының белгілі бөлігі бөлініп шығады. Сондықтан бұл процесс экзотермиялық процесс (өздігінен жүретін) болып табылады.
Кристалдық энергиясы бір моль затқа шыққан жылудың кило-калориясымен есептеледі. Осы өлшемдердің негізінде кристалдық структура энергиясы төмендегідей өрнекпен анықталады:
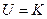
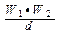 немесе U= K
немесе U= K 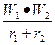 ,
,
мұндағы: U – кристалдық структура энергиясы;
W1 және W2 – иондардың валенттігі;
r1 және r2 – иондардың радиусы;
Өрнектегі коэффициент (К) энергияны өлшеудің әдісіне қарай табылады. А.Е. Ферсман мынандай формула қолданған:
U=293 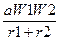 ,
,
мұндағы «а» әрпі Маделунг коэффициенті деп аталады. Ол кристалдық струк-турасына қарай өзгеретін шама. Соған сүйене отырып А.Ф. Капустинский мынадай формула ұсынды:
U=256,1 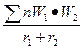 ,
,
мұндағы 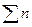 молекуладағы иондардың жалпысының жиыны.
молекуладағы иондардың жалпысының жиыны.
Кристалдық энергиясы аз болған сайын олардың өсу температурасы да төмен болады.
Дата добавления: 2016-12-08; просмотров: 4302;
