Железо и его соединения
Железо является вторым после алюминия металлом по распространенности в природе. Характерные степени окисления железа, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
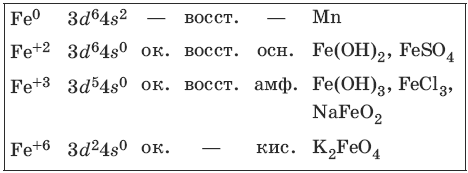
Соединения железа (+8) малохарактерны.
Получение и свойства железа
3Fe2O3 + CO →t → 2Fe3O4 + CO2
Fe3O4 + CO →t → 3FeO + CO2
FeO + CO →t → Fe + CO2
3Fe3O4 + 8Al →t → 9Fe + 4Al2O3
Fe + I2 →t → FeI2
2Fe + ЗCl2 →t → 2FeCl3
4Fe + 3O2 + 2Н2O = 4FeO(OH)↓ (коррозия на воздухе)
Fe + 2HCl = FeCl2 + Н2
Fe + H2SO4 (разб.) = FeSO4 + H2
Fe + 4HNO3 (разб.) = Fe(NO3)3 + NO + 2H2O
Концентрированные серная и азотная кислоты пассивируют железо на холоду. При нагревании реакция идет.
2Fe + 6H2SO4(конц.) →t → Fe2(SO4)3 + 3SO2 + 6Н2O
Fe + 6НNO3(конц.) →t → Fe(NO3)3 + 3NO2 + 3H2O
Свойства соединений железа (+2)
FeO + Н2O ≠
FeO + H2SO4 = FeSO4 + H2O
FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4
Гидроксид железа(II) сразу окисляется кислородом воздуха.
4Fe(OH)2↓ + 2Н2O + O2 = 4Fe(OH)3↓
Fe(OH)2↓ + H2SO4 = FeSO4 + 2Н2O
Fe(OH)2↓ + 2NaOH *
FeSO4 + 6KCN = K4[Fe(CN)6] + K2SO4
FeSO4 + K3[Fe(CN)6] = KFe[Fe(CN)6]↓ + K2SO4
Свойства соединений железа (+3 )
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
Fe(OH)3↓ + 3HCl = FeCl3 + 3H2O
Fe(OH)3↓ + NaOH ≠ не идет в разбавленном растворе
Fe(OH)3↓ + NaOH →сплавление → NaFeO2 + 2H2O
FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl
FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]↓ + 3KCl
FeCl3 + 3KCNS = Fe(SCN)3 + 3KCl
Свойства соединений железа (+6)
Феррат калия – окислитель.
Fe2O3 + 3KNO3 + 4KOH →сплавление → 2K2FeO4 + 3KNO2 + 2H2O
4K2FeO4 + 10H2SO4(разб.) = 2Fe2(SO4)3 + 3O2↑ + 4K2SO4 + 10H2O
Медь и ее соединения
Медь – мягкий красный металл, хорошо проводит теплоту и электрический ток.
Получение и свойства меди
2CuS + 3O2 →t → 2CuO + 2SO2
CuO + CO →t → Cu + CO2
Cu + 2HCl + Н2O2 = CuCl2 + 2Н2O
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2Н2O
Cu + 4НЖ)3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
4Cu + O2(недостаток) →200 °C → 2Cu2O
2Cu + O2(избыток) →500 °C → 2CuO
2Cu + H2O + CO2 + O2 = (CuOH)2CO3↓ (малахит)
Свойства соединений меди(I)
2Cu2O + O2 →500 °C → 4CuO
Cu2O + CO →t → 2Cu + CO2
Cu2O + 4(NH3 • Н2O) (конц.) = 2[Cu(NH3)2]OH + 3H2O
Свойства соединений меди(II)
CuO + 2HCl = CuCl2 + Н2O
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Cu(OH)2↓ →t → CuO↓ + Н2O
Cu(OH)2↓ + H2SO4 = CuSO4 + 2H2O
Cu(OH)2↓ + NaOH ≠ не идет в растворе
Cu(OH)2↓ + 2NaOH (конц.) →t → Na2[Cu(OH)4]
CuSO4 + 4(NH3 • H2O) = [Cu(NH3)4]SO4 + 4Н2O
[Cu(NH3)4]SO4 + Na2S = CuS↓ + Na2SO4 + 4NH3
2CuSO4 + 2H2O ↔ (CuOH)2SO4 + H2SO4
2CuSO4 + 4KI = 2CuI↓ + I2 + 2K2SO4
2Cu(NO3)2 →t → 2CuO + 4NO2 + O2
Серебро и его соединения
3Ag + 4HNO3 (разб.) = 3AgNO3 + NO↑ + 2H2O
2AgNO3 + 2NaOH = Ag2O↓ + H2O + 2NaNO3
AgNO3 + HCl = AgCl↓ + HNO3
AgCl↓ + 2(NH3 • H2O) = [Ag(NH3)2]Cl + 2H2O
[Ag(NH3)2]Cl + 2HNO3 = AgCl↓ + 2NH4NO3
Ag2O + 4(NH3 • Н2O) (конц.) = 2[Ag(NH3)2]OH + 3H2O
2[Ag(NH3)2]OH + CH3CHO + 2H2O = 2Ag↓ + CH3COONH4 + 3(NH3 • H2O)
Дата добавления: 2016-04-23; просмотров: 2629;
