Сера и ее соединения
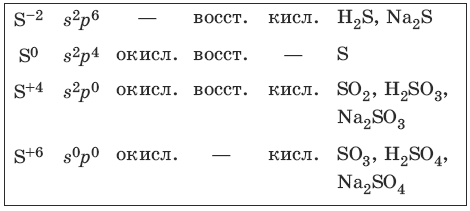
Характерные степени окисления серы, соответствующие им электронные формулы, химические свойства и примеры соединений приведены в таблице.
Чистая сера – хрупкое кристаллическое вещество желтого цвета. Сера имеет несколько модификаций: ромбоэдрическую и призматическую, также пластическую (аморфную). Аллотропия серы обусловлена различной структурой кристаллов, построенных из восьмиатомных молекул S8. В расплаве серы существуют молекулы S8, S6, в парах серы – молекулы S6, S4, S2.
Получение и свойства серы
FeS2 →t → FeS + S
SO2 + 2H2S = 3S + 2H2O
S + O2 →t → SO2
Fe + S →t → FeS
Hg + S = HgS
S + 6HNO3(конц.) = H2SO4 + 6NO2 + 2H2O
Получение и свойства соединений серы(-2)
FeS + 2HCl = FeCl2 + H2S
H2S ↔ H+ + HS¯ ↔ 2H+ + S2-
2H2S + O2 (недостаток) = 2S↓ + 2H2O
2H2S + 3O2 (избыток) →t → 2SO2 + 2H2O
2H2S + SO2 = 3S↓ + 2H2O
H2S + I2 = S↓+ 2HI
5H2S + 3H2SO4 + 2KMnO4 = 5S↓ + 2MnSO4 + K2SO4 + 8H2O
3H2S + 4H2SO4 + K2Cr2O7 = 3S↓ + Cr2(SO4)3 + K2SO4 + 7H2O
2NaOH + H2S = Na2S + 2H2O
Na2S + 2H2O ↔ NaHS + NaOH
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
3Na2S + Cr2(SO4)3 + 6H2O = 2Cr(OH)3↑ + 3H2S↑+ 3Na2SO4
Получение и свойства соединений серы(+4)
S + О2 →t → SO2
4FeS2 + 11O2 →t → 2Fe2O3 + 8SO2
SO2 + Н2O ↔ H2SO3 ↔ Н+ + HSO3¯ ↔ 2Н+ + SO32-
Na2SO3 + 2HCl = 2NaCl + H2O + SO2↑
SO2 + NaOH = NaHSO3
SO2 + 2NaOH = Na2SO3 + H2O
H2SO3 + 2H2S = 3S↓ + 3H2O
2SO2 + O2 →p, t, Pt → 2SO3
H2SO3 + Cl2 + H2O = H2SO4 + 2HCl
5SO2 + 2H2O + 2KMnO4 = 2H2SO4 + 2MnSO4 + K2SO4
Получение и свойства соединений серы(+6)
4FeS2 + 11O2 →t → 2Fe2O3 + 8SO2
2SO2 + O2 →p, t, V2O5 → 2SO3
H2O + SO3 = H2SO4
H2SO4 + SO3 = H2SO4 • SO3 = H2S2O7 (олеум)
H2S2O7 + H2O = 2H2SO4
Fe + H2SO4 (разб.) = FeSO4 + H2
Cu + H2SO4 (разб.) ≠
H2SO4(конц.) + H2O = H2SO4 • H2O + Q
Концентрированная серная кислота пассивирует на холоду Al, Fe, Cr.
2Fe + 6H2SO4 (конц.) →t → Fe2(SO4)3 + 3SO2 + 6Н2O
Cu + 2H2SO4 (конц.) →t → CuSO4 + SO2 + 2Н2O
3Zn + 4H2SO4 (конц.) = 3ZnSO4 + S + 4H2O
4Ca + 5H2SO4 (конц.) = 4CaSO4 + H2S + 4H2O
2H2SO4 (конц.) + S →t → 3SO2 + H2O
2H2SO4 (конц.) + С →t → 2SO2 + CO2 + 2H2O
VIIA-группa
Атомы галогенов, образующих VIIA-группу, имеют электронную конфигурацию ns2np5. Все галогены являются активными неметаллами, окислителями. Их активность уменьшается в ряду F > Cl > Br > I > At. Характерные степени окисления галогенов: -1, 0, +1, +3, +5, +7. Однако у фтора, наиболее активного неметалла, есть лишь степени окисления -1 и 0. F2 и Cl2 – газы, Br2 – жидкость, I2 – твердое вещество. С увеличением радиуса атомов галогенов растет объем их атомов и молекул, а также их поляризуемость. Это приводит к увеличению сил межмолекулярного взаимодействия (сил Ван дер Ваальса) и повышению температур плавления и кипения простых веществ.
HF, HCl, HBr, HI при растворении в воде образуют кислоты (HF – слабую, HCl, HBr и HI – сильные). В HF имеются сильные водородные связи. В ряду HCl – HBr – HI сила кислот несколько увеличивается в связи с увеличением поляризуемости молекул, пропорциональной их объему.
Электронная формула атома водорода 1s1. С галогенами его объединяет способность принимать один электрон и образовывать стабильную электронную оболочку 1s2. Поэтому часто водород располагают вместе с галогенами в VIIA-группе.
Дата добавления: 2016-04-23; просмотров: 2417;
