Качественные реакции
| Катион | Реактив | Эффект | Уравнение реакции |
| Ag+ | KI | Желтый творожистый осадок, не растворим в NH4OH, но растворяется в Na2S2O3 | AgNO3+KI=AgI↓+KNO3 Ag++I--=AgI↓ AgI+2Na2S2O3= =Na3[Ag(S2O3)2]+NaI AgI+3Na++2S2O32--= =Na3[Ag(S2O3)2]+I-- |
| Ag+ | K2CrO4 | Кирпично-красный осадок растворим в HNO3, NH4OH, трудно-растворим в уксусной кислоте | 2AgNO3+K2CrO4= =Ag2CrO4↓+2KNO3 2Ag++CrO42--=Ag2CrO4↓ |
| NaOH | Черный осадок растворим в HNO3 при нагревании | 2AgNO3+2NaOH= =Ag2O↓+H2O+2NaNO3 2Ag++2OH--=Ag2O↓+H2O | |
| Na2S2O3 | Белый осадок (растворим в избытке реактива) быстро переходящий в желтый, черный осадок | 2AgNO3+Na2S2O3= =Ag2S2O3↓+2NaNO3 Ag2S2O3=Ag2SO3↓+S↓ Ag2SO3+S+H2O= =Ag2S↓+H2SO4 Ag2S2O3+3Na2S2O3(изб)= =2Na3[Ag(S2O3)2] | |
| Реакция се-ребряного зеркала (реакция среды – слабощело-чная) | AgNO3+2NH4OH= =[Ag(NH3)2]NO3+2H2O 2[Ag(NH3)2]NO3+ +H2CO+H2O=2Ag↓+ +NH3↑+HCOONH4+ +NH4NO3 | ||
| KI (реакция среды – слабокис-лая) | Желтый осадок (+уксусная кислота + вода, нагреть до растворения осадка, при резком охлаждении раствора под струей холодной воды выпадает осадок в виде золотых чешуек) | Pb(NO3)2+2KI= =PbI2↓+2KNO3 Pb2+ +2I--=PbI2↓ | |
| K2CrO4 | Желтый осадок ма-лорастворим в HNO3 и уксусной кислоте, но растворяется в щелочах | Pb(NO3)2+K2CrO4= =PbCrO4↓+2KNO3 Pb2+ +CrO42--=PbCrO4↓ | |
| Pb2+ | H2SO4 | Белый осадок, растворим при нагревании в растворе щелочей | Pb(NO3)2+H2SO4= =PbSO4↓+2HNO3 Pb2+ +SO42--=PbSO4↓ PbSO4+4NaOH= =Na2PbO2+H2SO4+2H2O |
| NaOH | Белый осадок растворим в кислотах и щелочах | Pb(NO3)2+2NaOH= =Pb(OH)2↓+2NaNO3 Pb2+ +2OH--=Pb(OH)2↓ | |
| Na2S | Черный осадок растворим в HNO3 | Pb(CH3COO)2+Na2S= =PbS↓+2CH3COONa Pb2+ +S2--=PbS↓ 3PbS+8HNO3= =3Pb(NO3)2+3S↓+ +2NO↑+4H2O | |
| Hg22+ | Раствор дитизона в хлорофор-ме | Слой хлороформа окрашивается в красный цвет | |
| KI | Грязно-зеленый осадок, растворим в избытке реактива | Hg2Cl2+2KI=Hg2I2↓+2KCl Hg22++2I--=Hg2I2↓ Hg2I2+2KI (изб) =K2[HgI4]+Hg↓ | |
| K2CrO4 | Красно-бурый осадок, растворим в концен-трированной HNO3 и не растворим в щелочах | Hg2Cl2+K2CrO4= =Hg2CrO4↓+2KCl Hg22++CrO42--=Hg2CrO4↓ | |
| Hg22+ | NaOH | Черный осадок | Hg2Cl2+2NaOH= =Hg2O↓+2NaCl+H2O Hg22++2OH--=Hg2O↓+H2O |
| Дифенил-карбазид | Синий осадок или синее окрашивание |
Вопросы для самопроверки
1. Назовите катионы, относящиеся ко второй аналитической группе, групповой реактив. Охарактеризуйте растворимость осадков.
2. Какой цвет имеют осадки, образованные катионами второй группы с K2CrO4? KI? NaOH? Напишите уравнения реакций.
3. В какой цвет окрашивается слой хлороформа, при взаимодействии катионов Ag+ и Pb2+ с раствором дитизона в хлороформе?
4. Какой осадок образуется при взаимодействии Hg22+ и дифенилкарбазида?
Сводная таблица на реакции катионов второй аналитической группы
| Реактив | Ag+ | Pb2+ | Hg22+ |
| Cl-- | AgCl – белый творожистый осадок, раство-римый в растворе аммиака, Na2S2O3, (NH4)2CO3 | PbCl2 – белый хлопьевидный осадок, раст-воримый в горячей воде | Hg2Cl2 – белый осадок, при растворении в растворе аммиака выпадает черный осадок |
| I-- | AgI – желтый творожистый осадок, не раст-ворим в растворе аммиака, растворим в Na2S2O3 | PbI2 –желтый осадок | Hg2I2 - зеленоватый осадок, растворимый в избытке реактива |
| K2CrO4 | Ag2CrO4 –кирпично-красный осадок, растворимый в азотной кислоте, растворе аммиака, трудно растворим в уксусной кислоте | PbCrO4 – желтый осадок, мало растворимый в азотной и уксусной кислотах, рас-творимый в щелочах | Hg2CrO4 – красно-бурый осадок, растворимый в концентрированной азотной кислоте, не растворимый в щелочах |
| NaOH | Ag2O – черный осадок, раство-римый в азотной кислоте при наг-ревании | Pb(OH)2 – белый осадок, раство-римый в кислотах и щелочах | Hg2O – черный осадок, растворимый в азотной кислоте |
| Na2S2O3 | Белый осадок (Ag2S2O3), переходящий в желтый (S), а затем в чер-ный(Ag2S) | ||
| KI | AgI – желтый осадок, не раст-воримый в NH4OH, растворимый в Na2S2O3 | PbI2 – золотисто-желтый осадок, растворимый в избытке KI | Hg2I2 –зеленый осадок, растворим в избытке KI |
| H2SO4 | Ag2SO4 – белый осадок, раство-римый в горячей воде | PbSO4 – белый осадок, растворим в щелочах при нагревании | Hg2SO4 – белый осадок, растворимый в царской водке |
| Na2S | ? см. в литературе | PbS – черный осадок, раст-воримый в азотной кислоте | ? см. в литературе |
| Раствор дитизона в хлороформе | Слой хлороформа окрашивается в желтый цвет | Слой хлороформа окрашивается в красный цвет | |
| Дифенилкарбазид | Синий осадок или синее окрашивание |
Схема анализа смеси катионов первой и второй аналитических групп.
 |
 |
+HCl
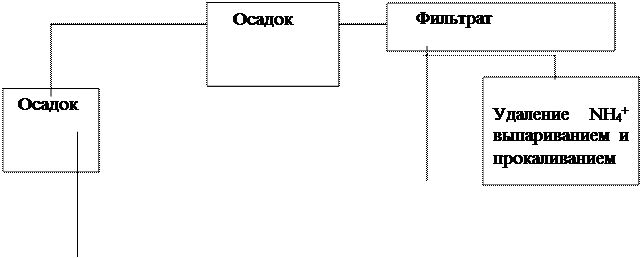

 горячая вода
горячая вода
| |||||||
 | |||||||
|
| ||||||
 |
| |||
 | |||
+NH4OH
| |||||
| |||||
 | |||||
|

+HNO3
|
Дата добавления: 2016-11-02; просмотров: 4316;
