СИСТЕМНАЯ ПРОГРЕССИРУЮЩАЯ ДЕЗОРГАНИЗАЦИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ КАК СЛЕДСТВИЕ СИНТЕЗА АНОМАЛЬНОГО БЕЛКА
Этот вид системной прогрессирующей дезорганизации соединительной ткани представлен своеобразным стромально-сосуди-
стым (мезенхимальным) диспротеинозом — системным, или генерализованным, амилоидозом.
В 1844 г. венский патолог К.Рокитанский описал изменения паренхиматозных органов, которые, становясь плотными и ломкими, приобретали сальный вид. Так возникло понятие о "сальной болезни" Рокитанского. Несколько лет спустя Р.Вирхов назвал вещество, появляющееся в органах при "сальной болезни", амилоидом, поскольку под действием йода и серной кислоты оно, подобно крахмалу, окрашивалось в синий цвет. Потребовалось 20 лет для того, чтобы опровергнуть утверждения Р.Вирхова и доказать белковую природу амилоида [Руднев М.М. и Kiihne W., 1865].
Амилоид— гликодротеид, основным компонентом которого является фибриллярный белок (F-компонент), имеющий характерную ультраструктуру. F-компонент связан в амилоиде с плазменными глюкопротеидами (Р-компонент). Оба эти компонента обладают антигенными свойствами. Амилоидное вещество мета-хроматично, дает характерную люминесценцию с тиофлавинами.
Белок амилоидных фибрилл синтезируется клетками, которые получили название "амилоидобласты" (В.В.Серов). Они представлены при генерализованном амилоидозе макрофагами, плазматическими клетками, кардиомиоцитами, гладкими мышечными клетками сосудов идр. Фибриллы амилоида образуются на цитолемме амилоидобластов в ее инвагинатах.
Образующееся амилоидное вещество выпадает по ходу ретикулярных (периретикулярный амилоидоз) либо коллагеновых (периколлагеновый амилоидоз) волокон. Встречается и смешанный вариант выпадения амилоида.
Выпадая в тканях, амилоид вытесняет специализированные клетки паренхиматозных органов и замещает клетки стенки сосудов. Его рост напоминает рост опухоли.
Генерализованный амилоидозможет быть проявлением самостоятельного заболевания — приобретенного (первичный, или идиопатический; старческий) или наследственного (наследственный), может быть осложнением болезни или второй болезнью (вторичный, или реактивный, амилоидоз).
В последние два десятилетия благодаря успехам биохимии, иммунологии, генетики и молекулярной биологии в проблеме амилоидоза получены новые факты, позволяющие пересмотреть многие ее положения.
1. Доказана гетерогенность белка амилоидных фибрилл — выделено несколько видов специфического фибриллярного белка амилоида — A A, AL, FAP, ASCj. Это значит, что единого амилоида при генерализованном амилоидозе нет, существуют различные его виды. На основании био(гисто)химических признаков очерчены группы генерализованного амилоидоза — АА-, AL-, FAP-, ASCj-амилоидоз. Выделение таких групп амилоидоза оказалось весьма перспективным. Оно показало, что каждая из этих групп представлена этиологически разными его формами (схема 5).
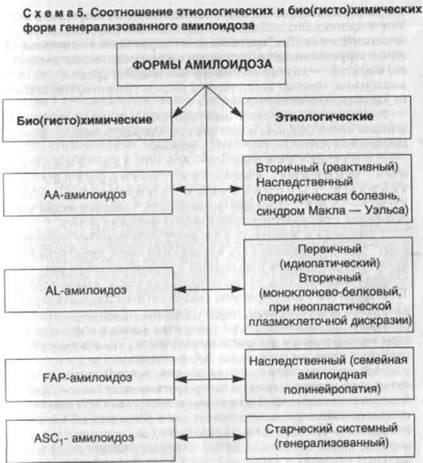
АА-амилоидоз включает не только вторичные (реактивные) формы, но и наследственные — периодическую болезнь и синдром Макла — Уэльса.
AL-амилоидоз представлен первичным амилоидозом и амилоидозом при так называемой неопластической плазмокле-точной дискразии, или "моноклоново-белковым амилоидозом".
FAP-амилоидоз — это семейная амилоидная полиней-ропатия, этническая принадлежность которой оказалась достаточно широкой: заболевание встречается не только в Португалии, как считали раньше, но и в Японии, Швеции, Англии, Польше, Греции, Германии, Израиле.
АSС1 рамилоидоз — старческий системный амилоидоз.
Эти данные свидетельствуют об условности деления амилои-доза в зависимости от возможной причины его возникновения,
 т.е. на первичный, вторичный, наследственный, старческий и т.д. Условность такого деления подтверждается и рядом более убедительных фактов. Так, среди больных первичным амилоидозом, с одной стороны, найдена подгруппа с плазмоклеточной дискрази-
т.е. на первичный, вторичный, наследственный, старческий и т.д. Условность такого деления подтверждается и рядом более убедительных фактов. Так, среди больных первичным амилоидозом, с одной стороны, найдена подгруппа с плазмоклеточной дискрази-
ей, с другой_ случаи семейного амилоидоза; среди форм АА-
ам'илоидоза, помимо вторичного и наследственного, описываются идиопатические случаи.
2. Идентифицированы циркулирующие в крови предшественники белка фибрилл амилоида при генерализованных формах амилоидоза АА-, AL-, FAP-, ASC1-формы.
Предшественником АА-белка амилоид
ных фибрилл является а-глобулин, на
званный сывороточным амилоидным бел
ком _ S А А . Доказана возможность трансформации его в
АА-белок с образованием амилоидных фибрилл in vivo.
У человека и животных SAA ведет себя подобно "острофазному" белку: содержание его в сыворотке после применения воспалительного стимула повышается в несколько сотен раз. Установлено влияние SAA на активность киллеров, взаимодействие Т-лимфоцитов с макрофагами, синтез антител плазматическими клетками. Таким образом, можно говорить об определенной связи между содержанием SAA в сыворотке крови и состоянием систем моноцитарного фагоцита и лимфоцита. Это открывает перспективы изучения патогенеза АА-амилоидоза.
SAA синтезируется главным образом гепатоцитами, хотя показана возможность синтеза его и другими клетками — фибро-бластами и полиморфно-ядерными лейкоцитами. В гепатоцитах осуществляются не только синтез, но и деградация SAA до его субъединиц, что определяет постоянство содержания SAA в сыворотке крови в ничтожных (до 1 мкг/мл) количествах в нормальных условиях. Содержание SAA в сыворотке крови зависит и от активности макрофагальной системы. Часть циркулирующего SAA фильтруется в почечных клубочках и реабсорбирует-ся - это второй путь метаболизма SAA. Об этом свидетельствует обнаружение SAA в подоцитах и мезангиальных клетках, способных к фагоцитозу. Второй путь метаболизма SAA позволяет понять особую "заинтересованность" почек при АА-амилоидозе ("нефропатический амилоидоз").
Предшественником AL-белка амилоидных фибрилл (моноклонального белка) являются X -и к-легкие цепи иммуноглобулинов или их фрагменты. Среди легких цепей найдены определенные, более амилоидогенные типы. Белок амилоидных фибрилл образуется из сывороточного предшественника либо при нарушении деградации моноклональных легких цепей, что ведет к появлению
промежуточных полипептидов, способных к агрегации в фибриллы, либо при возникновении легких цепей с особыми структурами в связи с "аминокислотными заменами". Один из этих механизмов предусматривает участие в построении амилоидных фибрилл клеток, способных к деградации, другой — способных к синтезу белка.
При FAP-амилоидозе белок фибрилл амилоида образуется из преальбумина плазмы с различными "аминокислотными заменами" при разных этнических вариантах FAP, что пытаются объяснить образованием мутантов. Выявленное высокое содержание преальбумина в цереброспинальной (спинномозговой) жидкости связывают с активным синтезом его хориоидальным сплетением. Этим объясняют особенности клинической симптоматики полинейропатии. В сыворотке крови у больных FAP-амилои-дозом и в группе риска уровень преальбумина снижен в 4—6 раз, что отличает этот амилоидоз от других форм генерализованного амилоидоза и свидетельствует о расходовании предшественника на построение белка амилоидных фибрилл. Однако депрессию преальбумина при FAP-амилоидозе можно рассматривать и как генетически запрограммированное нарушение его метаболизма.
При старческом системном амилоидозе предшественником фибриллярного белка ASC1, который рассматривается как мутантный белок, также является сывороточный пре-альбумин. Считают, что в связи с нарушением метаболизма преальбумина в пожилом и старческом возрасте склонность к образованию ASC1 из циркулирующего в крови предшественника повышается, чем и объясняют снижение содержания преальбумина в сыворотке при этой форме амилоидоза. Не исключается аффинность предшественника к определенным тканям (кардио-миоцит, гладкая мышечная клетка сосудов).
На основании приведенных данных можно обосновать патогенез АА- и AL-форм генерализованного амилоидоза.
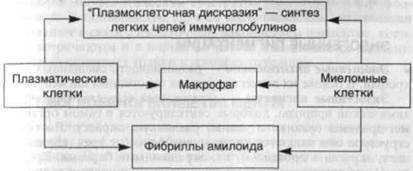
Патогенез АА-амилоидоза. Основные этапы патогенеза АА-амилоидоза следующие (схема 6):
- стимуляция синтеза SAA (печень) интерлейкином-1 в результате активации системы моноцитарных фагоцитов, что ведет к резкому увеличению содержания предшественника АА-белка в плазме крови;
- усиленная, но неполная ферментативная дегратация SAA макрофагами, появление белка АА;
- сборка на поверхности макрофагов-амилоидобластов фибрилл амилоида из фрагментов деградирующего SAA (белка АА) под воздействием амилоидстимулирующего фактора (АСФ) и при участии деградирующей активности сыворотки (ДАС). В этой системе следует найти место второму (почечному) пути ме-
|
| С х е м а 7. Патогенез AL-амилоидоза |
таболизма SAA, о котором уже упоминалось и которой делает понятным преимущественное поражение почек при АА-амилои-дозе.
Дата добавления: 2016-11-02; просмотров: 673;
