ПРИГОТОВЛЕНИЕ РАСТВОРА
Для приготовления раствора необходимо знать растворимость вещества в граммах, приходящихся на 100 г растворителя. Так как форма выражения концентрации, употребляемая разными авторами, различна, следует знать разные способы выражения концентраций и уметь их переводить в удобную форму. Наиболее употребительны следующие формы выражения концентрации:
1) массовая доля, % (процент вещества, содержащегося в растворе, масса которого принята за 100%);
2) массовая концентрация (число граммов вещества, содержащегося в 1 кг раствора);
3) объемная концентрация (число граммов вещества, содержащегося в 1 л раствора);
4) мольная доля, % (процент молей вещества, содержащихся в растворе, от общего количества молей);
5) в молях на 1000 г растворителя (моляльная шкала) и в молях на 1000 см3 раствора (молярная шкала).
Массовые концентрации обозначают обычно буквой с, мольные — буквой т.
Пересчет из одной формы выражения концентрации в другую нетруден. Лишь для перехода от объемной концентрации или от молярной шкалы и обратно к ним требуются сведения о плотностях растворов. В связи с этим данные по растворимости, выраженные по указанным двум способам, сообщаются обычно вместе с данными по плотности растворов.
Источники справочных сведений о растворимости приведены в § 2.1. Справочные сведения указывают, как правило, на растворимость безводных веществ. Реактивы же нередко представляют собой кристаллогидраты. Поэтому при определении количества вещества, необходимого для приготовления раствора, следует учитывать присутствие в нем кристаллизационной воды. Пересчет концентрации безводной соли на эквивалентную растворимость водной соли производится по формуле, г водной соли/100 г растворителя,
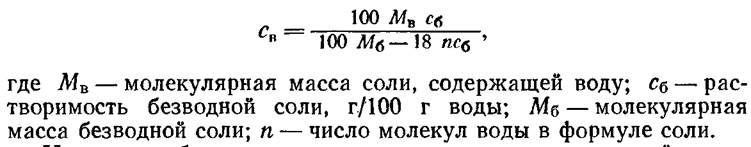
наряду с табличными данными полезно иметь под рукой также график растворимости. В случае отсутствия сведений по растворимости ее приходится определять самостоятельно по методам, описанным в § 4.3.
При приготовлении растворов используются приемы, аналогичные применяемым в химии. Обращают лишь особое внимание на то, чтобы уменьшить до минимума потерю растворителя на испарение и по возможности предотвратить разложение растворяемого вещества и растворителя, если они неустойчивы.
Последовательность операций при приготовлении растворов следующая.
1. Отмеривают растворитель. При этом пользуются обычной мерной химической посудой: при небольших объемах растворителя — бюреткой, при больших объемах — мензурками, мерными стаканами. При отсутствии мерной посуды растворитель взвешивают. Для добавления и отбора малых количеств жидкости пользуются пипетками.
2. Исходное вещество растирают в ступке и взвешивают. Взвешивание производится на аналитических или технических весах, в зависимости от количества вещества. Следует подчеркнуть, что погрешность взвешивания может не превышать 0,5—1%. Большая точность не имеет смысла, потому что данные по растворимости обычно имеют погрешность порядка указанных 0,5—1%, используемое вещество содержит какое-то количество влаги из-за гигроскопичности (иногда значительной!) или, наоборот, если реактив кристаллогидрат, то он может быть частично обезвожен.* Какие-то потери растворяемого вещества и растворителя при приготовлении раствора неизбежны. Таким образом, независимо от того, с какой точностью взвешивается навеска и отмеривается растворитель, все равно в дальнейшем придется определять температуру насыщения приготовленного раствора.
3. Вещество засыпают в колбу с растворителем, предварительно нагретым до температуры, на 10—20° С выше предполагаемой температуры насыщения. Затем колбу с растворителем и растворяемым веществом выдерживают при этой температуре, с тем чтобы ускорить процесс растворения вещества. Значительного перегрева, тем более вскипания, раствора надо избегать, так как это увеличивает потерю растворителя. В процессе растворения необходимо перемешивать содержимое колбы до полного растворения — с помощью магнитной мешалки, взбалтыванием и т. п. Для того чтобы избежать перегрева раствора, колбу при нагревании помещают в водяную баню.
Колбу с раствором при растворении следует держать закрытой. Пробка при этом ни в коем случае не должна быть вставлена плотно. Если это стеклянная притертая пробка, то под нее подсовывают полоску фильтровальной бумаги. Лучше всего в горло колбы вертикально вставить холодильник, через который пропустить воду из водопровода, или просто вставить в нее длинную стеклянную трубку. Конденсирующийся на стенках холодильника (или стеклянной трубки) растворитель стекает обратно в колбу и почти не теряется. Выход внутренней трубки холодильника прикрывают сверху ватным тампоном или колпачком из фильтровальной бумаги.
Если вещество влажное, его необходимо высушить. Относительно влажности веществ см. книгу Г. Ф. Ничуговского [1977 г.]. Если вещество является кристаллогидратом и потеряло часть кристаллизационной воды, что легко обнаруживается по местному изменению цвета, его либо прокаливают до полного обезвоживания, либо перекристаллизовывают, чтобы восстановить его водность.
4. Не давая раствору остыть, его фильтруют. Отфильтрованный раствор должен быть закрыт, т. е. изолирован от попадания из воздуха пыли, в том числе растворенного вещества, которое также содержится в воздухе. Загрязнение раствора кристаллической пылью повлечет за собой в дальнейшем появление паразитических кристаллов, а пыль биологическая может вызвать как запаразичивание, так и рост грибковых колоний в растворе. Такому заражению часто подвергаются растворы квасцов, аспарагина, глюкозы и др.
Кроме того, воздух, особенно в больших промышленных районах, содержит копоть и масла (работа автомобилей, котельных и т. п.). Установлено, что такого рода загрязнения воздуха в некоторых случаях ухудшают качество кристаллов.
При повышенных требованиях к совершенству и чистоте кристалла работу производят в самостоятельно изготовленных или выпускаемых промышленностью боксах из органического стекла.
Когда нет данных о растворимости вещества и нет возможности ее определить, необходимый раствор получают вымешиванием. Концентрация, соответствующая насыщению при данной температуре, в принципе может быть достигнута двумя путями: либо растворением вещества при этой температуре, либо высадкой излишнего вещества из пересыщенного раствора. Как правило, предпочитают первый способ, так как процесс растворения идет быстрее процесса кристаллизации. Разница в скоростях роста и растворения иногда бывает очень резко выражена.
Технически вымешивание осуществляется просто. В кристаллизатор (см. рис. 5-2) засыпают вещество, заливают растворитель и на уровне 1/4 высоты раствора устанавливают мешалку, изготовленную, например, из стеклянной палочки и куска листового фторопласта толщиной 1—2 мм. В нем делают отверстие по диаметру палочки. На конце стеклянной палочки, в свою очередь, делают два утолщения на расстоянии 3—5 мм друг от друга. После этого утолщение палочки с усилием проталкивают через отверстие во фторопласте, и фторопласт фиксируется между утолщениями.
Колебательное движение мешалки при некоторой подобранной амплитуде и частоте вызывает взмучивание осадка и хорошее перемешивание. Для установления равновесия между раствором и твердой фазой достаточно обычно 1, реже 2 сут. По истечении этого времени движение мешалки прекращают и в течение 1—2 ч раствору дают отстояться. Затем осторожно, чтобы не взмутить осадок, раствор переливают в колбу (декантируют). Полученный раствор несколько перегревают, чтобы растворить отдельные частички, оставшиеся в нем после декантации. Если для вымешивания использовалось предварительно перекристаллизованное вещество, то фильтровать этот раствор не нужно.
Дата добавления: 2016-09-20; просмотров: 2278;
