РАСТВОРИМОСТЬ И ДВИЖУЩАЯ СИЛА КРИСТАЛЛИЗАЦИИ
Растворы характеризуются в первую очередь концентрацией составляющих их веществ и температурой.
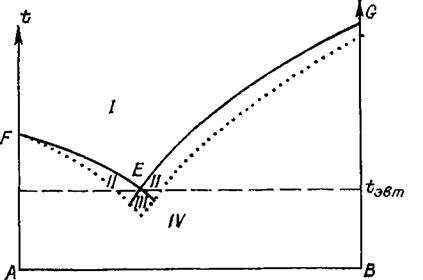 Рассмотрим типичную диаграмму растворимости в двухкомпонентной системе (рис. 1-8). Точка А соответствует чистому компоненту А, точка В — чистому компоненту В, промежуточные точки
Рассмотрим типичную диаграмму растворимости в двухкомпонентной системе (рис. 1-8). Точка А соответствует чистому компоненту А, точка В — чистому компоненту В, промежуточные точки
на линии АВ отражают пропорции в составе смеси А+В в данном
масштабе. Все поле концентраций разделяется линией насыщенных
растворов (кривой растворимости) FEG на две области — ненасыщенных (/) и пересыщенных (//—///) растворов.
В области ненасыщенных
растворов происходит
растворение кристаллов, в
области пересыщенных
растворов — кристаллизация (правее точки Е из
растворов кристаллизуется вещество В, левее—вещество А). На линии FEG кристаллы находятся в равновесии с раствором, Т. е. не происходит ни роста, ни растворения
рис.. 1-8 Диаграмма состояния двухкомпонентной системы с эвтектикой.
Пояснения см. в тексте.
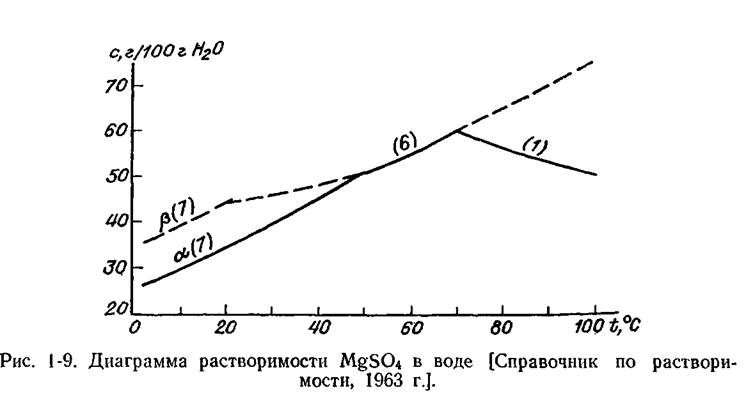
Цифры при кривых в скобках указывают на число молекул воды в соответствующем кристаллогидрате; αиβ —разные модификации.
При этом на линии FЕ раствор насыщен относительно А, на линии EG — относительно В, а в точке Е (эвтектическая точка) — относительно обоих веществ. В области /// происходит кристаллизация обоих веществ. Растворы, имеющие состав, соответствующий области IV, не существуют. Граница между областью IV и лежащей выше областью возможных растворов приблизительна, что связано с особенностями поведения пересыщенных растворов (§ 1.4).
График на рис. 1-8 соответствует случаю, когда компонент А совершенно не входит в структуру кристалла вещества В, и наоборот, т. е. между обоими компонентами нет смесимости в твердом состоянии (вещества не изоморфны между собой).
В качестве растворителя обычно используется вещество с более низкой температурой плавления (в данном случае А), поэтому нас интересует правая часть диаграммы. Как видно на рис. 1-8, концентрация насыщенных растворов В в А растет с увеличением температуры. Это справедливо для подавляющего большинства веществ. Однако в редких случаях растворимость с возрастанием температуры падает: Li2S04, MgSO4. H2O в воде (рис- 1-9).
Растворимость характеризуется абсолютным значением растворимости и ее температурным коэффициентом, который равен изменению растворимости при изменении температуры на 1°С. Температурный коэффициент растворимости может быть как положительным (растворимость растет), так и отрицательным (растворимость падает с температурой).
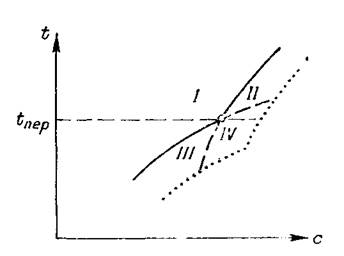
Если вещество В имеет несколько полиморфных модификаций или кристаллогидратов разной водности, на кривой растворимости обнаруживаются изломы (рис. 1-9 и 1-10), соответствующие температурам превращения этих фаз. Продлив ветви кривой за точку излома на ней в область пересыщенных растворов, получим кривые метастабильного (неустойчивого) равновесия одной кристаллической формы с пересыщенным раствором другой. В поле I
|
Рис. 1-10. Кривые растворимости для
Дата добавления: 2016-09-20; просмотров: 1191;
