Связь энтропии и энергии в закрытых системах
Основными способами передачи энергии от одного объекта к другому, внутри систем или между системами в окружающем человечество мире являются теплота и работа.
Сообщить объекту количество теплоты, необходимой для его нагревания, означает передать ему энергию строго определенным способом, используя разность температур между более нагретым объектом к менее нагретому, а для того, чтобы отвести от объекта энергию, необходимо его охладить, произведя обратное действие с использованием разности температур между охлаждаемым и более холодным объектом. Процесс передачи и отведение энергии за счет теплоты возможен при нарушении теплового равновесия между объектами внутри системы или между системами.
Тепловое равновесие между объектами внутри системы и между системами существует только в том случае, если система А приведена в тепловой контакт с системой В, однако результирующие потоки энергии отсутствуют (16).
Таким образом, теплота – один из способов передачи энергии, а работа, производимая при этом – это преобразование теплоты, изменение энергии объекта без использования разности температур.
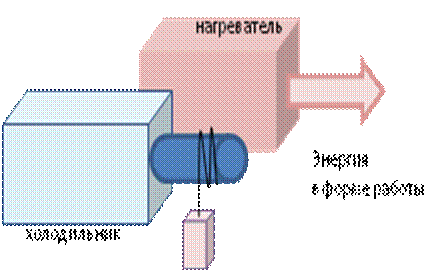
Рис. 2. Схема передачи энергии от системы к окружающей среде (на примере циклов Карно при совершении работы по подъему и опусканию грузов)
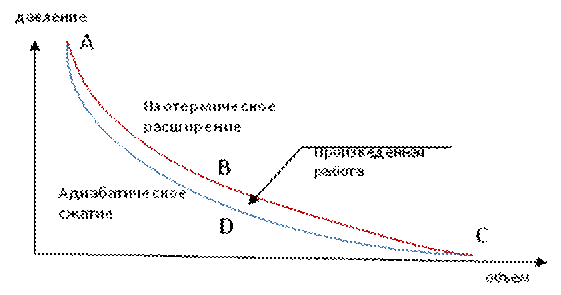
Рис. 3. Индикаторная диаграмма цикла Карно для закрытых систем:
АВ и CD - изотермы; BC DA – адиабаты.
Работа является, как и теплота, процессом передачи энергии другим способом за счет асимметрии происходящего при этом процесса (рис. 2), и чем больше разница между изотермическим расширением и адиабатическим сжатием (асимметрией процесса), происходящими при этом, тем больше объем производимой работы (коэффициент полезного действия КПД) (рис. 3).
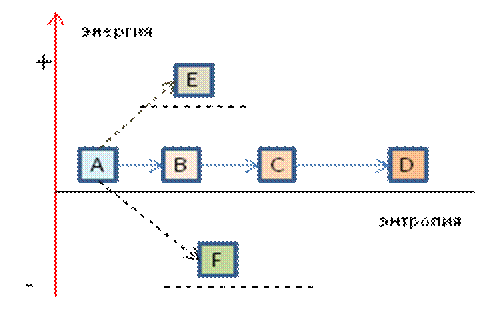
Рис. 4. Изолированная (закрытая) система:
переход из первоначального состояния А с той же энергией в состояния B, C и D в соответствии с началами термодинамики;
переходы закрытой системы в состояния E и F, отличающиеся по энергии от первоначального, противоречат первому началу термодинамики (сохранения энергии).
Система в результате работы, произведенной при перераспределении энергии в виде теплоты, переходит в новое состояние, в зависимости от объема или величины работы, при этом с сохранением энергии внутри системы и энтропийного состояния самой системы (рис. 4).
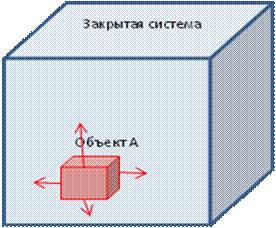
Рис. 5. Схема воздействия внутри закрытой системы объекта А, находящегося в другом состоянии (обладающим большей температурой (теплотой), чем остальные объекты системы, на всю систему в целом, при этом при обмене энергией между объектами внутри системы общая энергия системы остается постоянной.
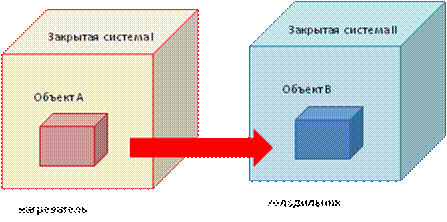
Рис. 6. Схема энтропии закрытых систем:
Закрытая система I, содержащая «нагреватель», находится в ином состоянии, чем система II, содержащая аналогичный объект «холодильника», при этом обе системы имеют одинаковый объем энергии и неизменную величину энтропии.
Направление самопроизвольного изменения состояния систем при их взаимодействии (переход от «горячего» к «холодному») определяется свойством энтропии этих систем.
Переход объекта (закрытой системы) из одного состояния в другое имеет количественные ограничения, налагаемые вторым началом термодинамики (асимметрией, однонаправленностью всех происходящих в ней самопроизвольных процессов). Такие ограничения определяются свойством системы спонтанно достигать того или иного конечного состояния (энтропии) после воздействия на нее теплотой (работой).
Состояния B, C и D могут быть получены из состояния А только в том случае, если полная (общая) энергия системы одинакова во всех состояниях A, B, C и D (рис. 4).
Если внутри закрытой системы один из ее объектов обладает другими свойствами, чем остальные объекты и вся система в целом, то данный объект воздействует на систему, не меняя ее свойств и общего количества энергии внутри системы (рис. 5).
Вместе с тем, если взаимодействуют две закрытые системы, одна из которых имеет объект, обладающий большей энергией, чем вся система, а другая система - объект, обладающий меньшей энергией, чем сама система, это приведет к самопроизвольному изменению состояния систем (переход от «горячего» к «холодному») (рис. 6).
Отсюда энтропия как признак закрытой системы определяется таким образом (16) (рис. 7):
если энтропия выше в состоянии В, чем в состоянии А, то состояние В может возникнуть самопроизвольно из состояния А;
если даже энергия системы в состояниях А и В одинакова, но энтропия состояния В меньше энтропии состояния А, то состояние В не может возникнуть самопроизвольно;
для перехода из состояния А в состояние В необходимо нарушить изоляцию закрытой системы с помощью технического устройства (например, холодильника) и принудить перейти ее из состояния А в состояние В (рис. 6);
в результате перехода системы из состояния А в состояние В будет изменение состояния системы.
энтропия
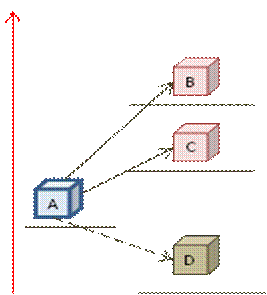
Рис. 7. Схема состояния системы при различных значениях энтропии
Состояния A, B, C и D (рис. 7) обладают одинаковыми энергиями, но различными значениями энтропии. Переходы из состояния А в состояния В или С могут происходить самопроизвольно, поскольку каждый из них сопряжен с увеличением энтропии.
Переход из состояния А в состояние D не происходит сам по себе, поскольку для этого необходимо понизить состояние энтропии системы, которая всегда стремится вверх по оси энтропии, а все естественные процессы внутри системы сопровождаются возрастанием энтропии системы.
Данные определяющие значения энтропии являются основным принципом энтропии.
Изменение энтропии системы происходит в следующих случаях:
изменяется по возрастающей - при ее нагревании (возрастании ее тепловых (температурных) показателей);
остается неизменной при совершении над ней работы;
уменьшается при охлаждении (остывании) системы.
При этом возрастание энтропии идет быстрее, если температура системы низкая (16):
изменение энтропии=сообщенная теплота/температура
Если энергия сообщается системе посредством нагревания, то сообщенная теплота положительна, и изменение энтропии тоже положительно (энтропия возрастает). Возрастание энтропии системы является характерным признаком естественных процессов и соответствует запасанию энергии при все более низких температурах, естественное направление процессов изменения характеризуется понижением качества энергии. Таковы все происходящие в природе естественные процессы.
Сжигая ископаемое топливо, человечество не уменьшает общих запасов энергии, находящейся в природе, происходит лишь понижение ее качества, при общем неизменном ее количестве. Но сжигая топливо, человечество увеличивает энтропию мира, поскольку все процессы по обмену теплом при этом протекают самопроизвольно, и любая работа, производимая в результате антропогенной деятельности в техносфере, приводит к понижению качества энергии окружающего мира, Земли и Вселенной в целом.
Поскольку в окружающем нас мире выполнение работы невозможно без энтропии, достижение предела возможного понижения температуры до абсолютного нуля (-273°С или 0°К Кельвина) нереально, а эффективность преобразования теплоты в работу (КПД) не может превысить единицу, что привело бы к неограниченному росту энтропии (1/0=¥).
По современным научным данным, материя нашей Вселенной состоит лишь из 10% всей существующей материи, рамки лучевого излучения тоже ограничены, при этом высокие температуры ограничиваются температурами Солнца и других звезд Вселенной (9).
Границы существующего мира сужаются, и пока неизвестно, что лежит за гранью абсолютного нуля температур, границами сверхвысоких температур и скорости света, в пределах 90% невидимой и непознанной материи: отрицательные энергии, сверхсветовые скорости или что-то более непознаваемое в виде новых Вселенных и миров.
Дата добавления: 2016-09-20; просмотров: 1236;
