На биологические объекты
| № этапа | Явление | Длительность этапа |
| Физико-химический этап (ионизация и возбуждение атомов и молекул) | 10-12 – 10-8 с | |
| Химический этап (образование свободных радикалов) | 10-7 с – несколько часов | |
| Биомолекулярный этап (повреждения белков, нуклеиновых кислот и других биомолекул) | 10-3 с – несколько часов | |
| Ранние биологические эффекты (гибель клеток, гибель организма) | Часы– недели | |
| Отдаленные биологические эффекты (опухоли, генетические эффекты, гибель организма и т. д.) | Годы – столетия |
Таким образом, начальное действие ионизирующих излучений происходит на атомном и молекулярном уровнях, затем, с течением времени, проявляется на клеточном, тканевом, органном и организменном уровнях.
Единой теории, объясняющей механизм действия излучения, нет. В механизме биологического действия ионизирующих излучений на живые объекты условно выделяют два основных этапа. Первый этап – первичное (непосредственное) действие излучения на биохимические процессы, функции и структуры органов и тканей. Второй этап – опосредованное действие, которое обуславливается изменениями, возникающими в организме под влиянием облучения. В результате многочисленных опытов, проведенных при облучении различных молекул, вирусов и бактерий, было предложено два теоретических направления, объясняющих механизм первичного действия ионизирующей радиации: 1) теория прямого действия излучений на молекулы, входящие в состав веществ и клеток; 2) теория косвенного действия.
Прохождение излучения через вещество или молекулы биологического субстрата сопровождается передачей энергии атомам вещества, что вызывает ионизацию и возбуждение атомов. Этот первый этап воздействия излучения характеризует акт прямого взаимодействия. Следовательно, под прямым действием ионизирующих излучений понимают такие изменения, которые возникают в результате поглощения энергии излучения самими молекулами, при этом поражающее действие связано с актом возбуждения и ионизации атомов и молекул. Под косвенным (непрямым) действием понимают изменение молекул клеток в результате взаимодействия их с продуктами радиолиза воды и растворенных в ней веществ, а не в результате поглощения ими энергии излучения.
На основе представления о прямом действии ионизирующих излучений возникла теория мишени и попаданий, выдвинутая Дессауэром в 1925 году, а затем дополненная Тимофеевым-Ресовским, Циммером, Ли и другими исследователями. Эта теория объясняла наличие в клетке жизненно важного центра — мишени, попадание в которую одной или нескольких высокоэнергетических частиц излучения может вызвать разрушение и гибель клетки. Попадание в мишень — вероятностное событие. Чем больше доза, тем оно вероятнее; чем меньше доза, тем оно менее вероятно, но по закону случайности попадания оно всегда возможно. В основе этой теории лежат два положения. Первое — принцип попадания — характеризует особенность излучения, которая заключается в дискретности поглощения энергии излучения, т.е. в поглощении порций энергии при случайном попадании в мишень. Второе — принцип мишени — учитывает особенность облучаемого объекта (клетки), т.е. различие в ее ответной реакции на одно и то же попадание. Эта теория приемлема только для простых систем.
Универсальной теорией радиобиологического действия ионизирующего излучения признана структурно-метаболическая теория Кузина А.М., предложенная в 1965 году. В основе теории лежит принцип многофакторности в проявлении любой радиобиологической реакции или радиобиологического эффекта. Автор выделил 6 общих принципов: дискретный характер передачи энергии; прямое и косвенное действие излучения; радиобиологические эффекты происходят у всех клеточных структур; генетические и физиологические нарушения передается по наследству; в клетке одновременно происходят процессы повреждения и восстановления; любой радиобиологический эффект развивается во времени. В облученной клетке происходит не только радиолиз (распад), но и синтез (образование) дополнительных высокореакционных продуктов, вызывающих повреждение макромолекул с образованием низкомолекулярных токсических метаболитов. Образование первичных радиотоксинов зависит от поглощенной дозы, времени облучения и носит экспоненциальный характер. После облучения образование радиотоксинов продолжается вследствие повышения активности ферментативных систем окисления, т.е. имеет место механизм биологического усиления начальных процессов.
Поражающий эффект определяется многими параметрами, в том числе наличием кислорода, концентрацией предшественников радиотоксинов, активностью ферментов, радиочувствительностью системы восстановления, концентрацией протекторных (защитных веществ), связью с окружающей средой. В этой теории ведущая роль в радиационном эффекте отводится нарушениям в клеточном ядре и биомембранах. Кузин А. М. ввел понятие о веществах, влияющих на геном клетки, и назвал их триггер-эффекторами. Триггер-эффекторы (хиноны, гормоны и др.), возникающие при облучении клетки, в зависимости от их концентрации могут оказывать депрессивное или репрессивное действие на геном клетки и на биосинтетические процессы.
При прохождении ионизирующих излучений через тканеподобное вещество происходят глубокие и практически необратимые перестройки атомов среды вещества. Судьба ионизированных и возбужденных атомов и молекул, образовавшихся после поглощения ионизирующего излучения, существенно зависит от химического состава и структуры поглощающей среды. Этапы формирования радиационного поражения клеток и тканей описаны многими схемами.
Например, Бак и Александер выделяют следующие этапы:
1) поглощение энергии ионизирующего излучения;
2) появление ионизированных и электронно-возбужденных молекул;
3) индуцирование изменений в молекулах;
4) развитие биохимических повреждений;
5) формирование субмикроскопических повреждений;
6) проявление видимых повреждений клеток;
7) гибель клетки.
Кузин А.М. в каждом этапе развития радиационно-биохимических процессов рассматривает реализацию определенных реакций, связанных с радиационно-химическими превращениями некоторых молекул в клетке.
Он предложил схему участия первичных радиотоксинов в развитии лучевого поражения организма (рис.3.).
Более 97 % общего состава живых организмов представлено легкими атомами водорода, кислорода, углерода, азота, серы, фосфора. Из этих элементов состоят основные компоненты биологических систем. В тканях животных и растений основная часть поглощенной энергии (70—85%) приходится на воду.
Молекулы воды составляют основу важнейших структур клетки, в воде растворены белки, нуклеиновые кислоты и другие компоненты клетки, которым может передаваться энергия, первоначально поглощенная водой.
Радиационно-химические реакции (радиолиз) молекулы воды хорошо изучены.
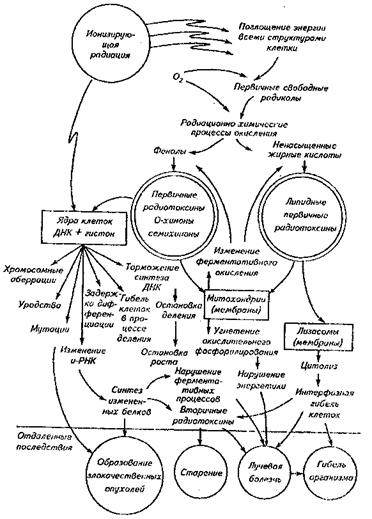
Рис. 3. Схема участия первичных радиотоксинов в развитии
лучевого поражения организма.
Первичные продукты радиолиза — свободный электрон и положительный ион, а также возбужденная молекула воды обладают свойствами, отличающимися от свойств электрически нейтральных молекул. Они распадаются с образованием высокореакционных свободных радикалов водорода (Но) и радикала гидроксила (ОНо). Свободные радикалы — это электрически нейтральные атомы или молекулы с неспаренным электроном на внешней оболочке. Радикалы в сотни раз активнее молекулы воды, так как имеют тенденцию «спаривать» неспаренный электрон с аналогичным электроном другого радикала. Время существования свободных радикалов составляет 2×10-7 секунды. Радиолиз молекул воды проходит в две стадии. Первая стадия состоит из двух процессов: 1) ионизация и возбуждение молекул; 2) образование свободных радикалов.
В результате ионизации молекулы воды возникает положительно заряженный ион Н2О+. Образование иона сопровождается потерей молекулой воды электрона, который превращается в гидратированный электрон (еag). Этот электрон обладает свойствами восстановителя, может соединяться с другой молекулой Н2О с образованием отрицательно заряженного иона Н2О- или с положительным ионом Н2О+ с образованием возбужденной молекулы воды Н2О*. Первый процесс можно представить в виде двух реакций:
 g®Н2О® Н2О+ + ē
g®Н2О® Н2О+ + ē
® + Н2О ® Н2О-
 Н2О+ + ē ® Н2О*
Н2О+ + ē ® Н2О*
Продолжительность существования ионов и возбужденной молекулы воды составляет 10-6 – 10-9 секунды. Они распадаются с образованием высокореакционных свободных радикалов водорода и гидроксила (Но и ОНо). Таким образом, первичные свободные радикалы Но и ОНо образуются из ионов молекулы воды и при диссоциации возбужденной молекулы воды:
Н2О+® Н+ + ОНо
Н2О- ® ОН- + Но
Н2О* Û Но + ОНо
Гидроксильные радикалы — сильные окислители, а радикал водорода имеет свойство восстановителя.
Во второй стадии происходит взаимодействие свободных радикалов друг с другом, с молекулами воды и с растворенными в воде молекулами различных веществ. Реакции могут идти следующими путями:
Но + Но ® Н2 — образование молекул водорода;
ОНо + ОНо ® Н2О2 — образование перекиси водорода;
ОНо + Но ® Н2О — рекомбинация, восстановление воды;
Н2О + Но ® Н2 + ОНо; Н2О + ОНо ® Н2О2 + Но — образование вторичных радикалов Но и ОНо;
RH + OHо ® Н2О + Rо ; RH + Hо ® Н2 + Rо — образование свободных радикалов различных молекул.
Радикалы, образовавшиеся при распаде возбужденной молекулы воды, обладают незначительной энергией, поэтому они не удаляются на большие расстояния друг от друга и подвергаются быстрой рекомбинации. Величины радиационно–химического выхода молекулы воды распределяются следующим образом: 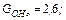
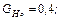
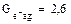 и небольшое количество Н2 и Н2О2. Выход измеряется числом образовавшихся или распавшихся молекул на 100 Эв поглощенной энергии излучения.
и небольшое количество Н2 и Н2О2. Выход измеряется числом образовавшихся или распавшихся молекул на 100 Эв поглощенной энергии излучения.
Взаимодействие свободных радикалов с органическими и неорганическими веществами идет по типу окислительно-восстановительных реакций и составляет эффект непрямого (косвенного) действия радиации. Величина прямого и непрямого действия ионизирующего излучения в первичных радиобиологических эффектах различных систем неодинакова. В абсолютно чистых сухих веществах преобладает прямое, а в слаборастворенных – косвенное действие. В клетках животных примерно 45% поглощенной энергии излучения действует непосредственно на молекулярные структуры – прямое действие.
При наличии в среде растворенного кислорода образуются гидропероксиды, первичным звеном которых является гидропероксидный радикал ( 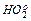 ), возникающий в результате реакции:
), возникающий в результате реакции:

Гидропероксиды могут взаимодействовать между собой, образуя пероксиды водорода (Н2О2) и высшие пероксиды (Н2О4), которые обладают высокой токсичностью. В клетке эти соединения разлагаются ферментом каталазой на воду и кислород.
При облучении водных растворов биологически важных молекул ионизирующей радиацией с низким значением ЛПЭ радикалы и другие активные формы радиолиза воды возникают на расстоянии друг от друга. Это способствует вступлению их в реакции с другими растворенными молекулами. Когда излучение характеризуется высоким значением ЛПЭ, в плотном треке происходит радикал–радикальное взаимодействие, т.е. участие радикалов в реакциях с молекулами растворимых веществ становится менее существенным.
Радиационно-химические превращения молекул обычно исследуются в одно-и двухкомпонентных системах. В клетке сосредоточены во взаимосвязи друг с другом молекулы самых разнообразных веществ, и развитие радиационно-химических реакций подчиняется закономерностям, свойственным сложным многокомпонентным системам. Реакции, наблюдающиеся в модельных системах, не всегда близки к реальной ситуации в облученной клетке. Полное описание радиационно-химических процессов в клетке и ткани представляет сложную задачу с многими нерешенными вопросами. Поэтому необходимо ограничиваться упрощенным подходом, обращая внимание на повреждение молекул, выполняющих наиболее важные функции в жизнедеятельности клетки. Биологически важные макромолекулы — нуклеиновые кислоты, белки, липиды, углеводы – образуют основные структурные единицы клетки — хромосомы, биомембраны, полиферментные системы, клеточные оболочки. Повреждение биологически важных молекул обуславливается радиационно-химическими превращениями (повреждениями) мономерных единиц, из которых они состоят. Степень нарушения функций макромолекулы зависит от выполняемой ею роли в клетке, степени уникальности, возможности ее замены из "резервных" молекул или синтеза новой идентичной макромолекулы.
Существенное значение для понимания процессов, которые происходят в клетках живых организмов при облучении, имеет изучение действия излучения на органические вещества. Экспериментально доказано, что под действием излучений разрываются связи в органических молекулах и они диссоциируют на отдельные фрагменты, т.е. происходит их деструкция с образованием ионов или свободных радикалов. На растворенные в воде вещества действие излучений может быть прямое, в результате чего возникают органические ионы и свободные радикалы, и косвенное, приводящее к образованию свободных органических радикалов и органических перекисей при взаимодействии продуктов радиолиза воды (Но, ОНо, Н2, и Н2О2) с органическими молекулами. Облучение водных растворов органических веществ может вызывать реакции димеризации и полимеризации органических соединений.
Наибольшую часть всех органических соединений в любом организме составляют белки, к основной функции которых относится ферментативный катализ. В состав белков входят 20 аминокислот. Молекулы большинства аминокислот имеют общую структуру:

Остаток R может иметь различное строение, что определяет специфичность свойств каждой аминокислоты и ее радиочувствительность. Набор аминокислот, их количество и последовательность расположения в белковой молекуле определяет первичную структуру белка. Аминокислоты при помощи пептидных связей (–СО–NH–) соединяются друг с другом, образуя каркас белковой молекулы. Атомы пептидных группировок располагаются в одной плоскости. Функциональные группы аминокислот (NH2, COOH, OH, SH, S–S и т.д.), расположенные в боковых отростках пептидной цепи, могут взаимодействовать между собой и с другими органическими соединениями, образуя сложные белки.
При действии ионизирующих излучений на белковые молекулы индуцируются изменения в аминокислотных остатках, образующих макромолекулу белка. Наиболее общими радиационно-химическими реакциями аминокислот являются следующие процессы:
1) дезаминирование, сопровождающееся разрывом связи С–N и образованием аминогрупп;
2) декарбоксилирование с разрывом связи С–С и образованием карбоксильных групп;
3) дегидрирование, при котором происходит расщепление связей
С– Н и N– Н и образование различных групп.
Различия в строении остатка R обуславливают специфику радиолиза каждой аминокислоты. С усложнением структуры молекулы аминокислоты и увеличением длины углеродной цепи возрастает частота разрывов и увеличивается количество продуктов радиолиза, т.е. возрастает радиочувствительность.
Установлено, что аминокислоты при облучении разлагаются преимущественно с отщеплением аммиака, т.е. происходит реакция дезаминирования. Радиационно-химический выход дезаминирования глицина, аргинина, аланина, лизина в водном растворе колеблется в пределах одной – пяти молекул NН3 на одну пару ионов. С повышением концентрации раствора, а также дозы облучения выход аммиака возрастает.
Рассмотрим радиолиз раствора глицина, при котором происходит реакция дезаминирования (доза 104 – 105 рад). Под действием излучения разрывается связь С–N. Возникающий свободный радикал 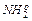 присоединяет из раствора радикал Но и превращается в аммиак:
присоединяет из раствора радикал Но и превращается в аммиак:
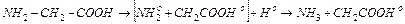
Среди аминокислот наибольшей радиочувствительностью обладают серосодержащие аминокислоты, у которых радиолиз просходит при меньших дозах. Хорошо изучен радиолиз цистеина — самой радиочувствительной из аминокислот. Под влиянием двух свободных радикалов ОНо сульфгидрильные группы двух молекул цистеина окисляются (отщепляется водород) и между двумя атомами серы замыкается связь с образованием молекулы цистина:


 Изучение действия излучения на белки позволяет выделить основные реакции повреждения белковой молекулы: отщепление водорода по связи С–Н от углеродного атома с образованием белкового радикала; расщепление белка с образованием амида и карбонильного соединения; нарушение и разрыв первичной структуры, сопровождающиеся образованием низкомолекулярных фрагментов и полимеризацией молекулы белка; денатурация — специфическая реакция белков на облучение, при которой белок переходит в нерастворимую форму без изменения химического состава; радиационно–химические нарушения аминокислот; инактивация ферментов, т.е. потеря способности ферментов регулировать процессы обмена веществ. В состав белков входят также наиболее радиочувствительные серосодержащие и ароматические аминокислоты. В водных растворах существенную роль в радиационных превращениях белковых молекул играют продукты радиолиза воды – радикал ОНо и гидратированный электрон e-aq. Свободнорадикальные образования могут локализовываться в определенных местах молекулы. Через промежуточные соединения, возникающие по центрам локализации свободнорадикальных соединений, белки расщепляются с образованием фрагментов белковых молекул. С участием свободных радикалов, локализованных в разных участках белковой молекулы, могут происходить процессы полимеризации и возникать ковалентные сшивки белков с молекулой ДНК. Облучение вызывает нарушение конформационного состояния, что приводит к ослаблению способности белка регулировать самосборку надмолекулярных структур. Хорошо изучена реакция на облучение водных растворов ферментов, катализирующих разложение нуклеиновых кислот и белков. Причинами инактивации могут быть изменения пространственной конфигурации фермента, развертывание белковой глобулы, а также изменение аминокислотного состава в результате повреждения поверхностных участков фермента. Образование продуктов радиолиза белковых молекул в живых клетках, облученных дозами, близкими к полулетальным, обычно невелико. Прямое повреждение белковых молекул, по-видимому, не имеет решающего значения для жизнеспособности клеток, так как в клетке много одинаковых молекул и возможен синтез новой идентичной белковой молекулы.
Изучение действия излучения на белки позволяет выделить основные реакции повреждения белковой молекулы: отщепление водорода по связи С–Н от углеродного атома с образованием белкового радикала; расщепление белка с образованием амида и карбонильного соединения; нарушение и разрыв первичной структуры, сопровождающиеся образованием низкомолекулярных фрагментов и полимеризацией молекулы белка; денатурация — специфическая реакция белков на облучение, при которой белок переходит в нерастворимую форму без изменения химического состава; радиационно–химические нарушения аминокислот; инактивация ферментов, т.е. потеря способности ферментов регулировать процессы обмена веществ. В состав белков входят также наиболее радиочувствительные серосодержащие и ароматические аминокислоты. В водных растворах существенную роль в радиационных превращениях белковых молекул играют продукты радиолиза воды – радикал ОНо и гидратированный электрон e-aq. Свободнорадикальные образования могут локализовываться в определенных местах молекулы. Через промежуточные соединения, возникающие по центрам локализации свободнорадикальных соединений, белки расщепляются с образованием фрагментов белковых молекул. С участием свободных радикалов, локализованных в разных участках белковой молекулы, могут происходить процессы полимеризации и возникать ковалентные сшивки белков с молекулой ДНК. Облучение вызывает нарушение конформационного состояния, что приводит к ослаблению способности белка регулировать самосборку надмолекулярных структур. Хорошо изучена реакция на облучение водных растворов ферментов, катализирующих разложение нуклеиновых кислот и белков. Причинами инактивации могут быть изменения пространственной конфигурации фермента, развертывание белковой глобулы, а также изменение аминокислотного состава в результате повреждения поверхностных участков фермента. Образование продуктов радиолиза белковых молекул в живых клетках, облученных дозами, близкими к полулетальным, обычно невелико. Прямое повреждение белковых молекул, по-видимому, не имеет решающего значения для жизнеспособности клеток, так как в клетке много одинаковых молекул и возможен синтез новой идентичной белковой молекулы.
Липиды находятся в клетке в довольно больших количествах и включаются в мембранную систему клетки. Радиолиз липидов сопровождается накоплением продуктов радиационно-химического превращения ненасыщенных жирных кислот, которые входят в состав липидов. Среди этих продуктов имеются перекиси и гидроперекиси — липидные перекиси. Выходы липидных перекисей могут составлять несколько сотен молекул на 100 эВ поглощенной энергии. Возникающие при этом нестабильные радикалы претерпевают ряд превращений, взаимодействуя с неповрежденными молекулами, друг с другом и c кислородом. В последней реакции образуется активный перекисный радикал, который, реагируя с исходной карбоновой кислотой, приводит к образованию гидроперекиси и нового перекисного радикала. Этой реакцией начинается цепной процесс окисления липидов, для продолжения которого необходимо наличие в среде кислорода. Конечными продуктами радиолиза жирных кислот являются карбонильные соединения, альдегиды, кетоны, спирты, углекислый газ. В живой клетке цепная реакция окисления липидов невозможна, потому что происходят одновременно другие реакции, препятствующие этому процессу.
Углеводы представлены в природе моносахаридами (4–8 атомов углерода) и полисахаридами (более 8 атомов углерода). Радиолиз моносахаридов сопровождается образованием дезоксисахаридов, дезоксикетосоединений, млоидиальдегида (МДА). Облучение полисахаридов вызывает разрыв углеродных связей и нарушение структуры, изменение физико-химических свойств, деполимеризацию, т.е. образование более простых молекул.
При радиолизе других органических молекул происходит нарушение их структуры в результате разрыва связей С–С, С–Н и связей углерода с функциональными группами С–R. Возникают радикалы различных типов. Среди продуктов появляются не только фрагменты углеводородной цепочки, но и продукты превращения функциональных групп. Например, при радиолизе спиртов, эфиров и кетонов образуется водород (реакция дегидрирования), при радиолизе органических кислот – двуокись углерода (реакция декарбоксилирования), при радиолизе аминов – аммиак (реакция дезаминирования). Происходят также реакции синтеза, т.е. образование более сложных молекул в результате полимеризации простых молекул и функциональных групп.
Действие ионизирующих излучений на нуклеиновые кислоты – ДНК, разные формы РНК и на их аналоги исследовано обстоятельно. Исследованиями доказано, что в развитии лучевого поражения клетки особо важное место принадлежит молекулярным повреждениям компонентов генетически важных молекул, в частности ДНК, входящей в состав хромосом. Определяющая роль повреждения ДНК основывается на том, что гигантские молекулы ДНК в гаплоидном наборе хромосом не повторяют друг друга, представляя собой уникальную структуру клетки. Поэтому исследование радиационно-химических повреждений молекул нуклеиновых кислот приобрело большое значение в раскрытии механизмов радиобиологических явлений.
Облучение ДНК в водных растворах и сухих препаратах вызывает в первую очередь радиолиз ее структурных единиц: оснований, нуклиотидов, углеводной части, а также молекулы. К основным радиационно-химическим реакциям оснований относят дезаминирование пуриновых оснований (аденина и гуанина) и цитозина, образование пиримидиновых и пуриновых радикалов при разрыве пиримидинового или имидазольного кольца, образование гидроперикисных радикалов, образование в водных растворах кетильных радикалов при участии радикалов Нo и ОНo. Повреждение оснований ДНК клетки может быть причиной генных мутаций организма.
Сведений о радиационно–химических изменениях нуклеозидов, нуклеотидов и нуклеиновых кислот значительно меньше. Однако они позволяют сделать вывод о том, что в основаниях, облученных в составе этих трех структурных единиц, происходят качественно те же изменения, что и в основаниях, облученных в свободном виде. Установлено, что выходы реакций оснований, входящих в состав молекулы ДНК, меньше, чем при облучении их в свободном состоянии. Это связано с тем, что часть продуктов радиолиза воды (в основном радикале ОНо) расходуется в конкурирующих реакциях с углеводной частью. Выходы разложения пиримидиновых оснований превышают выходы разложения пуриновых.
У дезоксирибозы, входящей в состав ДНК, облучение приводит к образованию дезоксирибозилрадикалов, которые возникают чаще всего при взаимодействии радикала ОНо с одним из атомов водорода дезоксирибозы. Эти радикалы претерпевают реакции дегидратации и гидролиза с образованием окислительных и восстановительных продуктов. В результате изменений в углеводной части происходит разрыв полинуклеотидных связей, сопровождающийся выделением свободных оснований. Связь 3¢РО4 более радиочувствительна, чем связь 5¢РО4. При действии продуктов радиолиза воды на углеродные атомы, не связанные с фосфорной группой, возникают неустойчивые соединения – лабильные фосфатные эфиры, которые, подвергаясь гидролизу, образуют дополнительное количество фосфорной кислоты.
Облучение растворов ДНК вызывает структурное изменение молекулы ДНК. Целостность “скелета” ДНК, или первичной структуры, определяется межуглеродными связями С3¢ – C4¢ ; C4¢ – C5¢ и фосфорными связями C5¢ – OPO – C3¢. Разрушение любой из этих связей приводит к одиночному (однонитевому) разрыву нуклеотидной цепи. Одиночные разрывы обнаруживают по уменьшению молекулярного веса одиночных нитей ДНК, а также по концентрации выделившегося фосфата, по выходу МДА (млоидиальдегида). По мере накопления одиночных разрывов (при увеличении дозы облучения) расстояние между ними в комплиментарных цепях уменьшается и возникают двойные разрывы, приводящие к уменьшению молекулярного веса ДНК. Количество двойных разрывов накапливается пропорционально квадрату дозы облучения. При облучении ДНК редкоионизирующим излучением соотношение между двойными и одиночными разрывами составляет от 1:20 до 1:50. Оно снижается с увеличением плотности ионизации.
Изменения во вторичной структуре молекулы проявляются в виде разрывов водородных связей между комплиментарными основаниями, что вызывает частичную денатурацию молекулы ДНК. Выход разрывов водородных связей рассчитывается по доле оснований, оставшихся спаренными в ДНК после облучения. Все разрывы молекулы ДНК разделяются на две группы: первичные, которые происходят в момент облучения под действием излучения, и пострадиационные, которые происходят после облучения, в результате радиационно-химических реакций молекулы ДНК с другими молекулами и свободными радикалами. На рисунке приведены схемы структурно-радиационных повреждений молекулы ДНК. На рис 4. указаны места в молекуле ДНК, где наиболее легко реализуется поглощенная энергия после миграции по молекуле.
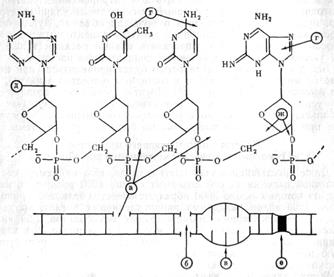
Рис.4. Основные радиационно-химические повреждения
молекулы ДНК
Обозначения: а) одиночные разрывы; б) двойные разрывы; в) частичная денатурация молекулы в результате распада п водородных мостиков; г) радиационные изменения оснований; д) отщепление оснований; е) образование сшивок; ж) распад дезоксирибозы.
При облучении сухой ДНК и ДНК, содержащей небольшое количество воды, было обнаружено увеличение ее молекулярного веса и зафиксировано образование разветвленных структур. Облученная в вакууме ДНК теряет растворимость. Эти факты объясняются образованием ковалентных сшивок (слипание нитей) в молекуле ДНК при облучении. Присутствие воды увеличивает образование сшивок, а наличие кислорода препятствует этому процессу. Известны сшивки нескольких типов: продольные (между поврежденными основаниями), поперечные (между двумя нитями ДНК) и сшивки между нитями ДНК и молекулами белка. Возникновение сшивок является результатом образования ковалентных связей 3-х типов: между двумя реакционно–способными концами полимерной цепи, между поврежденными основаниями и между поврежденными основаниями и сахарофосфатными остатками. Однако механизм образования и молекулярная природа сшивок не выяснены до конца.
Выход повреждений ДНК при облучении клеток дозами, вызывающими репродуктивную гибель клеток, т.е. потерю способности клеток к делению, незначителен. Однако и при очень малом выходе повреждений могут нарушаться структура и функции этих молекул в клетке. ДНК клетки, как объект радиобиологических реакций, существенно отличается от ДНК простых радиобиологических систем. В составе хромосом ДНК находится в виде двойной незамкнутой спирали. В митахондриях, пластидах и в клетках прокариот (клетки без ядер) ДНК представлена в виде двойной цепочки, замкнутой в кольцо. Клеточная (ядерная) ДНК хранит генетическую информацию клетки в виде генетического кода. Генетический код – это последовательность чередования нуклеотидов в молекуле ДНК, которая определяет порядок расположения аминокислот в белке. Облучение ДНК может привести к нарушению генетического кода и к появлению генных мутаций.
К настоящему времени доказано, что при облучении хромосомной ДНК клеток наблюдаются следующие первичные реакции: окисление пиримидиновых оснований и распад пуриновых оснований, обратимые и необратимые разрывы водородных связей, конфигурационные изменения надмолекулярных структур ДНК, внутри- и межмолекулярные сшивки полимерных цепей. В живых клетках ДНК связана с белками –гистонами, образуя самый сложный комплекс – хроматин, куда входят ДНК, РНК и белковые компоненты. Синтез ДНК и его задержка совпадают с этими же процессами у гистонов. Элементарная хромосомная нить образована спиралью ДНК, скрепленной гистонами. Облучение вызывает образование сшивок ДНК–белок. Главную роль в образовании сшивок играют продукты радиолиза пиримидиновых оснований (пиримидиновые и перекисные радикалы) и меньшую роль – продукты повреждения пуриновых оснований. При облучении клеток однонитевые разрывы вызывают потерю способности молекулы скручиваться в спираль и структура молекулы становится кольцевой. Двунитевые разрывы вызывают переход кольцевой структуры в линейную. Повреждения сахарофосфатных связей приводят к возникновению поперечных ковалентных сшивок ДНК–ДНК. При облучении клетки повышается активация ферментов ДНК–аз, которые вызывают деполимеризацию ДНК. Разрушение ядерных и цитоплазматических мембран при облучении создает условия для ферментативного повреждения молекулы ДНК. В клетке имеет место дистанционное действие на ДНК радиотоксинов – стабильных продуктов радиолиза клеточных и межклеточных молекул.
Следует отметить, что реакции, связанные с потерями и модификациями оснований, так же как и разрывы фосфороэфирных и межуглеродных связей, неспецифичны для ионизирующего излучения, так как выход многих продуктов этих реакций наблюдается при воздействии некоторых химических и физических факторов, клеточных ферментов типа эндо- и экзонуклеаз, ультрафиолетового излучения.
РНК, представленная в клетке несколькими формами (матричная, рибосомальная, транспортная), относится к массовым молекулярным структурам клетки, т.е. формы повторяются или содержатся в нескольких копиях, и, в отличие от ДНК, могут синтезироваться в требуемом количестве в клетке. Поэтому их радиационное повреждение менее значимо при лучевом поражении клетки. В основном, типы радиационного повреждения молекул РНК такие же, как и молекулы ДНК.
Клетка – элементарная биологическая система, способная к размножению. В живой клетке, как в отрегулированной биологической системе, изменение в какой-либо её части отражается на функционировании всей клетки.
Морфологические изменения в клетках обнаруживаются не сразу после облучения, а через некоторое время, которое неодинаково для разных клеток. Видимые изменения – это результат многочисленных сложных процессов в обмене веществ и невидимых изменений клеточных структур. При облучении клеток наблюдаются следующие морфологические изменения: увеличение размеров клеток, увеличение ядер, образование двухядерных и трехядерных клеток, дробление ядер, изменение формы клеток, многополюсные митозы, увеличение объема хромосом, слипание хромосом, образование фрагментов хромосом, которые могут вызывать гибель клеток.
Согласно правилу французских ученых Бергонье и Трибондо радиационная гибель клеток прямо пропорциональна интенсивности их деления и обратно пропорциональна уровню их дифференциации, т.е. делящиеся и молодые клетки очень чувствительны к облучению. К таким клеткам у растений относятся клетки меристем, обеспечивающие рост растений на протяжении всей жизни, а у животных и человека – клетки органов кроветворения: костного мозга и лимфатических желез. Эта закономерность явилась основой для радиотерапии злокачественных опухолей. Известно, что раковые клетки быстрее делятся, обладают меньшим уровнем дифференциации, чем клетки основной здоровой ткани, поэтому они менее радиоустойчивы, чем здоровые клетки.
Радиобиологические эффекты клеток зависят от дозы облучения, вида и энергии излучения, а также от типа, стадии жизненного цикла, возраста, функций клетки и других факторов. Облучение клетки вызывает: 1) повреждение клеточной мембраны, что приводит к усилению притока и оттока различных веществ в клетку и из клетки; 2) изменение консистенции цитоплазмы (коагуляция, разжижение); 3) нарушение структурных компонентов цитоплазмы; 4) повреждение ядерной мембраны и ядерных компонентов; 5) нарушение синтеза различных веществ и процессов обмена веществ в клетке; 6) гибель клетки.
В клетке критическим местом радиационного поражения является ядро, которое более радиочувствительно, чем цитоплазма, так как в нем находятся жизненно важные структуры – хромосомы и ДНК. Многие критерии радиационного поражения клетки (число хромосомных аберраций в первом митозе, митотическая активность, интенсивность синтеза ДНК) тесно связаны с функциями ядра. При оценке радиочувствительности клеток имеют значение такие показатели, как объем ядра, число хромосом и плоидность, объем интерфазных хромосом, содержание ДНК в ядре, а также функциональное состояние ее генетических структур (фаза клеточного цикла, обводненность, защищенность ДНК белками), наличие в клетке веществ, обладающих радиопротекторными свойствами, способность клеток к репарации.
Радиобиологические эффекты в клетке зависят от стадии её жизненного цикла в момент облучения. Многие радиационные повреждения легко переносятся клеткой и быстро восстанавливаются. Такие клеточные реакции называются физиологическими эффектами облучения. Они протекают в ближайшие сроки после облучения. Наиболее универсальная реакция делящихся клеток на облучение – временная задержка деления клеток или радиационное блокирование митоза. Реакция изучена на разных объектах in vivo и in vitro для нормальных и опухолевых клеток.
Задержка деления наблюдается у всех клеток облученной популяции и находится в прямой зависимости от дозы. Блокирование первого пострадиационного митоза наблюдается в диапазоне доз до 10 Гр. Время задержки неодинаково у различных клеток. Для большинства клеток оно составляет примерно один час на один грей и зависит от стадии клеточного цикла в момент облучения. Наиболее длительна задержка деления при облучении клетки в S–фазе (синтез ДНК) и G2–фазе (постсинтетический период ДНК). Самое короткое время задержки при облучении в митозе, когда большинство клеток находится в делении, которое заканчивается без остановки.
Механизм радиационной задержки деления окончательно не выяснен. Существует несколько точек зрения: 1) нарушение синтеза ДНК; 2) повреждение хромосом; 3) повреждение внутриклеточных структур, регулирующих деление; 4) накопление веществ, задерживающих деление клетки; 5) повреждение веществ, стимулирующих митоз; 6) нарушение механизма клеточного веретена и изменение его ориентации в анафазе; 7) нарушение клеточной и ядерной мембран; 8) защитно-приспособительная реакция клеток, подобная ответу на многие внешние факторы.
Радиочувствительность клеток в разных фазах жизненного цикла неодинакова. Наиболее радиочувствительны клетки, находящиеся в конце G1-фазы (предсинтетический период ДНК) и в начале S-фазы (синтез ДНК). Синтез ДНК – уникальное событие в клетке, после которого клетка перестает существовать, дав начало двум дочерним клеткам. Синтез ДНК осуществляется по матричному механизму, т.е. находящиеся в ядре молекулы ДНК являются матрицами, на которых воспроизводится копия их структуры, что приводит по окончанию синтеза к удвоению количества ДНК в клетке и идентичности вновь синтезируемой ДНК дочерних клеток матричной ДНК материнской клетки. Синтез ДНК связан с такими важнейшими радиационными эффектами, как задержка деления клеток, нарушение передачи наследственной информации, появление мутаций. Синтез ДНК – очень радиочувствительная реакция. В зависимости от дозы облучения реакция замедляется или вообще прекращается. Синтез ДНК может нарушаться на следующих этапах: 1) обменные реакции, приводящие к синтезу трифосфатов четырех нуклеотидов; 2) начало синтеза ДНК, связанного с освобождением молекулы ДНК от белков и раскручиванием цепи, присоединением ДНК-полимеразы; 3) синтез ДНК; 4) радиационное угнетение синтеза ряда ферментов, ответственных за синтез ДНК; 5) изменение в надмолекулярной организации хроматина и на других этапах. Косвенно на синтез ДНК могут оказывать влияние радиотоксины, которые всегда возникают в облученных клетках.
Наиболее важным проявлением действия излучения на клетки является подавление способности клеток к неограниченному размножению, что называется репродуктивной (пролиферативной), или митотической гибелью клетки. Неделящиеся клетки не всегда имеют признаки видимых повреждений и живут некоторое время после облучения. Видимая гибель клеток происходит в процессе первого пострадиационного деления, т.е. в первом митозе, а также во втором, третьем и четвертом митозах. Основной причиной гибели клеток являются структурные повреждения ДНК, которые обнаруживаются цитологическими методами в виде хромосомных аберраций. В репродуктивной гибели клеток основную роль играют такие хромосомные аберрации, как делеции (образование фрагментов хромосом) и транслокации (межхромосомные обмены).
Делеции бывают концевые и внутренние. При концевых делециях образуются ацентрические фрагменты (без центромеры) в результате повреждения одного или двух плечей хромосомы и кольцевая хромосома, которая образуется при замыкании двух поврежденных плечей в кольцо. Кольцевые хромосомы могут делиться в анафазе, распрямляться, переплетаться и образовывать петли. Они регистрируются только во время первого пострадиационного митоза, затем теряются с частотой 50% на деление. При внутренних делециях в результате двойного разрыва хромосомы выпадает её фрагмент. Оставшиеся части хромосомы соединяются и имеют укороченные размеры. Фрагменты хромосом остаются в цитоплазме и образуют микроядра в одной из дочерних клеток. Образование фрагментов приводит к потере генетической информации клеток. Потеря фрагментов не всегда приводит к гибели клеток в первых митозах. Гибель происходит в более поздних митозах.
Межхромосомные обмены могут быть симметричные (между гомологичными участками хромосом) и асимметричные (между негомологичными участками хромосом). Завершенные симметричные обмены не вызывают потерь генетического материала, не препятствуют делению клеток. В результате асимметричных обменов образуются: 1) дицентрические мосты, представляющие собой тяж (фрагмент) из хромосомного материала в области экватора между двумя дочерними клетками при делении материнской клетки; 2) кольцевые хромосомы; 3) микроядра из фрагментов. Мосты препятствуют нормальному расхождению хромосомного материала к полюсам клетки и делению клеток в анафазе, что приводит к гибели клетки. Завершенные асимметричные обмены, или реципрокные транслокации, являются источниками генетических нарушений, которые накапливаются в клетках и передаются из поколения в поколение, создавая “генетический груз” популяции и способствуя появлению мутаций.
Структурные аберрации хроматидного типа возникают во время удвоения и после удвоения хромосом. Аберрации могут захватывать одну хроматиду, обе хроматиды или часть её поперечного сечения. Для хроматидных аберраций характерны разнообразные межхроматидные обмены и более высокая степень незавершенности обменов.
Облучение клеток в очень высоких дозах вызывает прекращение метаболизма и гибель клеток. Эта форма инактивации клеток называется интерфазная гибель. Она наступает в первые часы после облучения, при этом наблюдается пикноз и фрагментация ядра, изменение формы ядерной и клеточной поверхности, фрагментация хромосом. При интерфазной гибели клеток происходит: 1) повышение или подавление аэробного гликолиза; 2) снижение содержания АТФ; 3) нарушение реакции окислительного фосфолирования; 4) накопление субстратов цикла Кребса и аминокислот; 5) усиление процессов повреждения оснований в молекулах нуклеиновых кислот; 6) изменение активности ферментов; 7) нарушение барьерных и регуляторных функций мембран. Для интерфазно гибнущих клеток характерно с увеличением дозы постепенное увеличение повреждений и наличие пороговой дозы облучения, после которой повреждения не зависят от дозы, так как не происходит их репарация и все клетки погибают.
Радиочувствительность ткани пропорциональна пролиферативной активности и обратно пропорциональна дифференцированности составляющих ее клеток. Пролиферативная активность – это интенсивность деления. Дифференцированность – разнородность клеток по структуре, функциям и фазам развития. Ткани представляют собой многоклеточные системы. В основе устойчивости многоклеточной системы к облучению и другим факторам лежит гетерогенность отдельных клеток. Клетки тканей имеют разные скорости прохождения фаз развития, причем изменение продолжительности клеточного цикла происходит чаще за счет G1-фазы (предсинтетический период ДНК) и реже – G2-фазы (постсинтетический период ДНК). Асинхронность деления и повышенная вероятность нахождения клеток в G1-фазе придает клеточной популяции высокую устойчивость к действию радиации и другим неблагоприятным факторам. Дополнительным фактором устойчивости тканей является включение в клеточную популяцию покоящихся клеток (Gо–клетки). Гетерогенность – общебиологическое явление, которое проявляется от популяций одноклеточных водорослей до меристем высших сосудистых растений. Наиболее радиочувствительные ткани растений — меристемы, или образовательные ткани, которые постоянно делятся и обеспечивают рост растений на протяжении всей их жизни. Радиобиологические эффекты или радиационное поражение растений связаны в первую очередь с повреждением меристем. Облучение растений в начальных этапах онтогенеза вызывает морфологические аномалии первых органов и замедление роста. Облучение в последующих этапах развития – нарушения воспроизводительной системы и отклонения в формировании семян. В зависимости от активности деления ткани меристемы различаются по радиочувствительности. Максимальная радиочувствительность у апикальной меристемы стебля, радиационное повреждение которой приводит к снятию апикального доминирования, что вызывает усиленное ветвление и кущение растений. Облучение меристем междоузлий приводит к уменьшению высоты растений. В течение онтогенеза имеются периоды повышенной активности меристематических зон, поэтому радиационные повреждения растения закономерно изменяются по степени радиобиологического эффекта и по спектру аномалий развития. Реакции растений на действие гамма– и рентгеновского излучения проявляются в виде активации или подавления ростовых процессов. Внешние признаки лучевого поражения наблюдаются в виде морфологических аномалий (или морфозов) органов: корня, стебля, листа, цветка, плода, семени. Характерные радиоморфозы растений при облучении – опухоли различных органов. В обычных условиях клетки меристем имеют постоянный клеточный поток. Под клеточным потоком понимают частоту прохождения клеток через любую фазу клеточного цикла. Под действием радиации часть клеток не вступает в деление, у части клеток задерживается деление, поэтому клеточный поток ослабевает. Меристема обладает очень гибкой и эффективной системой регуляции клеточных потоков в обычных условиях и при восстановительных процессах после ее повреждения. У облученных меристем может происходить восстановление структуры клеточной популяции и нормализация клеточного потока. В этом процессе участвуют 3 вида клеток: 1) клетки, сохранившие способность к делению; 2) клетки, прошедшие период восстановления; 3) клетки, находящиеся в покое. Этот процесс называется репопуляция. Доля необратимых лучевых поражений клеток и тканей варьирует в зависимости от условий облучения от 8 до 30% общего количества повреждений. Восстановление или репарация – это общебиологическое явление, которое начинается на молекулярном уровне и заканчивается на популяционном или биоценозном.
Известно, что причиной гибели клеток являются молекулярные повреждения ДНК, вызывающие однонитевые и двойные разрывы молекулы. Поэтому репарация клеток сводится к репарации ДНК. Выделяют 3 вида репарации ДНК: 1) дорепликативная; 2) репликативная; 3) пострепликативная. Дорепликативная репарация однонитевых разрывов может осуществляться двумя нитями: восстановление разрывов и экспозиция (вырезание) поврежденных оснований при участии ферментов (ДНК-лигазы, эндонуклиды и ДНК-полимеразы). Эксцизия сопровождается удалением поврежденного основания с участком ДНК и последующей его заменой таким же основанием, поэтому синтез ДНК происходит на восстановленной матрице. Предлагается существование 3-х типов репарации однонитевых разрывов: медленная (до 1 часа), быстрая (до 10 мин) и сверхбыстрая (до 2 мин). Для репарации двойных разрывов ДНК необходимо наличие поврежденных участков в гомоложной нити, по подобию которых формируется временные комплексы для восстановления поврежденных участков. При репликативной репарации повреждения восстанавливаются в зоне роста цепи ДНК. Восстановленная ДНК не всегда идентична исходной ДНК, поэтому сохранения измененной структуры ДНК в поколениях клеток является причиной отдаленных последствий. Пострепликативная репарация не всегда сопровождается полным восстановлением, поэтому дочерние нити могут иметь пробелы. Однако клетки сохраняют жизнеспособность несмотря на наличие дефектов. Выделяют одноэтапную репарацию ДНК, когда некоторые типы оснований восстанавливаются под влиянием специальных ферментов. Нарушения ДНК, возникающие в ходе репарации ДНК, называют ошибочной репарацией, в результате которой формируются вторичные повреждения структуры ДНК или остаются не восстановленными дефекты. Установлено, что при повреждении ДНК в облученных клетках возникают генные продукты, которых в норме нет в клетках. Эти продукты ускоряют репарацию и повышают радиоустойчивость клеток, что может иметь значение при адаптации к хроническому облучению.
Дата добавления: 2016-08-08; просмотров: 1178;
