Зависимость поверхностного натяжения жидкости от температуры.
Уравнение Гиббса для адсорбции позволяет рассчитывать зависимость поверхностного натяжения жидкости от концентрации растворённого вещества, если известна зависимость Адсорбции от концентрации, т. е. изотерма адсорбции. Для малых концентраций растворенного вещества уравнение изотерма Лангмюра имеет вид:
Г = zbC (1)
С другой стороны, адсорбция связана с концентрацией растворенного вещества и поверхностным натяжением по уравнению Гиббса для адсорбции:
Г = - 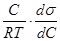 (2)
(2)
Приравнивая правые части уравнений (10 и (2), получим
zbC = - 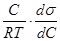 (3)
(3)
После разделения переменных можно записать:
- d 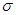 = zbRTdC (4)
= zbRTdC (4)
Проинтегрируем уравнение (4) в пределах σ0 - σ и 0 - С
- 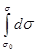 =
= 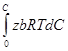 (5)
(5)
где σ0 - поверхностное натяжение растворителя;
σ-поверхностное натяжение раствора с концентрацией растворённого вещества С. После интегрирования получим:
σ = σ0 - zbRTС (6)
Для более высоких концентраций растворенного вещества в уравнение (3) подставим уравнение Лангмюра:
Г = 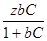 (7)
(7)
Тогда
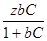 = -
= - 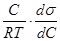 (8)
(8)
После разделения переменных и интегрирования получим:
- 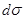 = zbRT
= zbRT 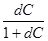 (9)
(9)
и
- 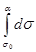 = zbRT
= zbRT 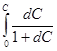 (10)
(10)
Откуда
σ = σ0 – zRTln(1 + bC) (11)
Полученное уравнение получило название уравнения Шишковского. 
.Ионная адсорбция
Адсорбция электролитов не укладывается в рамки молекулярной адсорбции. Адсорбент по-различному адсорбирует ионы, на которые распадается электролит. На адсорбцию ионов большое влияние оказывает природа адсорбента. Ионы адсорбируются обычно на поверхностях, состоящих из полярных молекул или из ионов. В этой связи ионную адсорбцию часто называют полярной адсорбцией. Микроучастки поверхности, несущие определенный заряд, адсорбируют противоположно заряженные ионы. При этом ионы электролита, имеющие противоположный заряд, не адсорбируются на поверхности адсорбента, а под действием электростатических сил остаются вблизи адсорбированных ионов, образуя на поверхности адсорбента двойной электрический слой. На адсорбционную способность ионов сильно влияет величина их радиуса. Из ионов одинаковой валентности адсорбционная способность возрастает с увеличением радиуса иона. Причина такого явления заключается в том, что ионы с большими радиусами больше подвержены поляризуемости, чем ионы с меньшими радиусами. Вследствие этого возрастает их способность адсорбироваться на поверхности адсорбента, состоящей из ионов и полярных молекул. Кроме того, чем больше радиус иона, тем меньше вокруг него гидратная оболочка, которая снижает электростатическое взаимодействие, а следовательно, и его адсорбционную способность. Ряды ионов, составленные в порядке повышения их адсорбционной способности получили название лиотропных рядов или рядов Гофмейстера. По возрастающей адсорбционной способности одновалентные катионы можно поставить в следующий ряд:
Li+ < Na+ < K+ < Rb+ < Cs+.
Для двух валентных ионов будет следующий ряд:
Mg2+ < Са2+ < Sr2+ < Ва2+.
Одновалентные анионы по их возрастающей способности адсорбироваться располагаются в следующей последовательности:
С1- < Вг- < I- < NCS-.
Адсорбционная способность ионов зависит от их валентности. Чем больше валентность иона, тем сильнее он притягивается противоположно заряженными микроучастками поверхности. Катионы различной валентности по их возрастающей способности адсорбироваться на поверхности жидкости можно расположить в следующий ряд:
К+ « Са2+ « А13+ « Th4+.
Обменная адсорбция
Если на поверхности адсорбента адсорбировался какой - либо электролит, то при контакте этого электролита с другим электролитом, то всегда в той или иной степени будет иметь место обменная адсорбция. При этом адсорбент, поглощая определённое количество каких - либо ионов, одновременно выделяет в раствор эквивалентное количество других ионов того же знака, вытесненных с поверхности. Обменная адсорбция имеет ряд особенностей.
Во-первых, к обмену способны только определённые ионы, т. е. обменная адсорбция специфична. В зависимости от химической природы ионов, которые могут обмениваться с ионами, содержащимися в адсорбенте, различают кислые и основные адсорбенты. Кислые адсорбенты ведут себя подобно кислоте и способны обменивать с растворами катионы, Основные адсорбенты по своим свойствам схожи с основаниями и способны обменивать анионы. Промежуточное положение занимают амфотерные адсорбенты, которые в одних условиях способны обменивать катионы, а в других - анионы.
Во- вторых, обменная адсорбция не всегда является обратимым процессом.
В - третьих, обменная адсорбция протекает, как правило, медленнее, чем молекулярная. Процесс обмена протекает особенно медленно, когда обменивающиеся ионы находятся в глубине адсорбента. В данном случае необходимо время для диффузионного проникновения ионов из раствора в глубь адсорбента и диффузии вытесненных ионов из глубины адсорбента в раствор,
В - четвертых, в результате протекания обменной адсорбции может изменяться рН среды. Если адсорбент заменяет ион водорода на какой - либо катион, то последний, поступая в раствор уменьшает его рН. При этом адсорбент выступает как кислота, Если же адсорбент обменивает ионы гидроксила на какой - либо другой анион, рН раствора будет повышаться. В этом случае адсорбент ведет себя как основание. В качестве примера таких обменов могут служить следующие схемы обмена адсорбента А с раствором соли NaCl:
(А) Н+ + Na+ + Cl- = (A) Na+ + Н+ + Сl-
(А) ОН- + Na+ + Сl- = (А) Сl- + Na++ Cl-
Количественно обмен ионами между твердым адсорбентом и раствором описывается уравнением, полученным Б.П.Никольским (1939 г.):
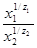 = K
= K 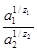 (1)
(1)
где x1 и x2 - содержание обменивающихся ионов в адсорбенте, г-экв./г;
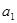 , и
, и 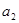 -активности обменивающихся ионов в растворе;
-активности обменивающихся ионов в растворе;
К - константа процесса обмена;
z1 и z2 -степень окисления ионов 1 и 2.
При z1 = z2 = 1 уравнение (1) принимает вид:
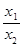 = K
= K 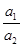 (2)
(2)
В случае небольших концентраций, раствор электролита можно считать идеальным раствором. В этом случае уравнение (2), описывающее адсорбционную способность ионов 1 и 2 можно записать в виде:
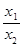 = K
= K 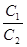 (3)
(3)
где C1 и С2 - концентрации ионов 1 и 2 в растворе.
Ионный обмен находит широкое применение в металлургической практике. Ониспользуется для извлечения различных цветных металлов из растворов, полученных при выщелачивании руд и концентратов, очистки сточных вод от металлургического производства
В случае небольших концентраций, раствор электролита можно считать идеальным раствором. В этом случае уравнение (2), описывающее адсорбционную способность ионов 1 и 2 можно записать в виде:
х2 С2 (3)
Где Ci и Сг - концентрации ионов 1 и 2 в растворе.
Ионный обмен находит широкое применение в металлургической практике. Он
используется для извлечения различных цветных металлов из растворов, полученных при
выщелачивании руд и концентратов, очистки сточных вод от металлургического
производства.
Дата добавления: 2016-08-07; просмотров: 849;
