Адсорбция на поверхности жидкости.
По своим энергетическим свойствам поверхность жидкости отличается от свойств в глубине жидкости. В поверхностном слое жидкости находятся молекулы с ненасыщенными связями. Вследствие этого поверхность жидкости обладает повышенным запасом свободной энергии Гиббса. Такое явление получило название поверхностного сгущения свободной энергии. Поверхностное сгущение свободной энергии, отнесенное к единице площади поверхности, называют поверхностным натяжением жидкости.
G 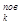 = σ (3.28)
= σ (3.28)
где G 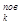 - поверхностное сгущение свободной энергии на ктой поверхности, отнесенное к единице площади;
- поверхностное сгущение свободной энергии на ктой поверхности, отнесенное к единице площади;
σ - поверхностное натяжение жидкости, Дж/м2 или Н/м.
Количественно поверхностное натяжение жидкости выражает собой работу, которую необходимо затратить, чтобы увеличить поверхность жидкости на единицу площади.
Между поверхностным натяжением и адсорбцией растворённого вещества на поверхности жидкости имеется связь, которая описывается уравнением Гиббса. Изменение энергии Гиббса системы вследствие имеющихся поверхностного натяжения и адсорбции на поверхности жидкости составит:
dG = VdT - SdT + μidСi + σdsi, (3.29)
где S – энтропия, Дж/K;
V - объём,м3;
Р - давление,Па/м2;
μiхимический потенциал растворённого вещества;
ds - изменение площади поверхности жидкости,м2;
σ - поверхностное натяжение, Н/м.
. Если система находится при постоянных Т и Р, то уравнение (3.29) примет вид:
dG= μidCi + σds (3.30)
После преобразования получим:
dG - μidCi- Cid μ0 = σdsi - Cidμi (3.31)
или
d(G – μiCi) = σdsi - Cidμi (3.32)
Левая часть уравнения (3.32) представляет собой полный дифференциал функции G – μiCi. Из свойств полного дифференциала можно записать:
( 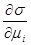 )s,P,T = - (
)s,P,T = - ( 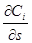 )μ,P,Т (3.33)
)μ,P,Т (3.33)
Выражение ( 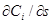 )μ,P,Т представляет собой поверхностное сгущение вещества, отнесённое к отнесённое к единице площади поверхности или адсорбцию Гi. Тогда
)μ,P,Т представляет собой поверхностное сгущение вещества, отнесённое к отнесённое к единице площади поверхности или адсорбцию Гi. Тогда
Гi = ( 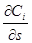 )μ,P,Т (3.34)
)μ,P,Т (3.34)
Для растворённого вещества уравнение химического потенциала имеет вид:
μi = μ 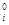
 + RTlnCi (3.35)
+ RTlnCi (3.35)
Откуда получим
( 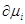 )s,P,T = RT(
)s,P,T = RT( 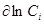 )s,P,T (3.36)
)s,P,T (3.36)
После подстановки (3.36) в (3.34) получим:
Гi = - 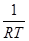 (
( 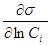 )s,P,T (3.38)
)s,P,T (3.38)
В условиях постоянства параметров s,P,T уравнение (3.38) можно записать в виде
Гi = - 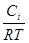
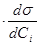 (3.39)
(3.39)
Уравнение (3.39) носит название уравнения Гиббса для адсорбции на поверхности жидкости. Для реальных растворов уравнение (3.39) будет иметь вид:
Гi = - 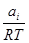
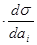 (3.40)
(3.40)
где 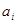 - термодинамическая активность растворённого вещества.
- термодинамическая активность растворённого вещества.
Величина 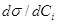 может быть рассчитана по приближенному уравнению:
может быть рассчитана по приближенному уравнению:
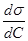 =
= 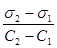 (3.41)
(3.41)
Если 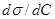 < 0, то с увеличением концентрации растворённого вещества на поверхностное натяжение жидкости уменьшается. Вещества, снижающие поверхностное натяжение жидкости, называются поверхностно - активными веществами (ПАВ). Молекулы этих веществ менее полярны, чем молекулы воды. К поверхностно - активным веществам относятся большинство органических растворимых в воде соединений :кислоты и их соли,амины, аминокислоты, белки и др. Из уравнения Гиббса следует, что если
< 0, то с увеличением концентрации растворённого вещества на поверхностное натяжение жидкости уменьшается. Вещества, снижающие поверхностное натяжение жидкости, называются поверхностно - активными веществами (ПАВ). Молекулы этих веществ менее полярны, чем молекулы воды. К поверхностно - активным веществам относятся большинство органических растворимых в воде соединений :кислоты и их соли,амины, аминокислоты, белки и др. Из уравнения Гиббса следует, что если 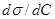 < 0, то Г> 0. Это означает, что концентрация растворённого вещества в поверхностном слое жидкости будет больше, чем в глубине раствора.
< 0, то Г> 0. Это означает, что концентрация растворённого вещества в поверхностном слое жидкости будет больше, чем в глубине раствора.
Если 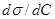 > 0, то с увеличением концентрации растворённого вещества поверхностное натяжение жидкости увеличивается. Вещества, повышающие поверхностное натяжение, называются поверхностно- инактивными веществами. Молекулы этих веществ обладают большей полярностью, чем молекулы воды. К ним относятся почти все водные растворы электролитов - кислот, солей и оснований, которые диссоциируют в воде на ионы. В этом случае концентрация растворённого вещества в поверхностном слое будет ниже, чем в глубине жидкости.
> 0, то с увеличением концентрации растворённого вещества поверхностное натяжение жидкости увеличивается. Вещества, повышающие поверхностное натяжение, называются поверхностно- инактивными веществами. Молекулы этих веществ обладают большей полярностью, чем молекулы воды. К ним относятся почти все водные растворы электролитов - кислот, солей и оснований, которые диссоциируют в воде на ионы. В этом случае концентрация растворённого вещества в поверхностном слое будет ниже, чем в глубине жидкости.
Если 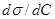 = 0, то поверхностное натяжение не зависит от концентрации растворенного вещества и его концентрация в поверхностном слое и в глубине раствора одинакова и адсорбция не наблюдается.
= 0, то поверхностное натяжение не зависит от концентрации растворенного вещества и его концентрация в поверхностном слое и в глубине раствора одинакова и адсорбция не наблюдается.
Величина - 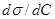 называется поверхностной активностью, которая является мерой способности вещества понижать поверхностное натяжение на границе раздела фаз. Эта величина равна производной
называется поверхностной активностью, которая является мерой способности вещества понижать поверхностное натяжение на границе раздела фаз. Эта величина равна производной 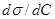 , взятой с обратным знаком при стремлении
, взятой с обратным знаком при стремлении
концентрации ПАВ к нулю:
g = - ( 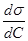 )Ci=0 (3.42)
)Ci=0 (3.42)
Зависимость поверхностного натяжения раствора от концентрации растворенного вещества приведена на рис 1. Эта зависимость позволяет графически оценить величину поверхностной активности вещества.
 |

 Рисунок 3.4 Зависимость поверхностного натяжения жидкости от концентрации растворённого вещества
Рисунок 3.4 Зависимость поверхностного натяжения жидкости от концентрации растворённого вещества
 Величина g зависит уменьшением полярности молекул растворённого вещества. Так у органических кислот она выше, чем у солей этих кислот. Для молекул с большим числом полярных групп значения g невелики и в некоторых случаях близки к нулю. При исследовании гомологических рядов органических кислот были обнаружены чёткие изменения g в каждом ряду. Такие же результаты были получены для гомологических рядов спиртов, аминов и других. На основании полученных данных было сформулировано правило, заключающееся в том, что поверхностная активность увеличивается в 3 - 3,5 раза при удлинении углеводородной цепи на одно звено СН2. Пр имени ученых, выявивших эту закономерность оно было названным правилом Дюкло - Траубе. Правило Дюкло - Траубе лежит в основе синтеза ПАВ, обладающих высокой поверхностной активностью. Эти вещества, содержащие длинную углеводородную цепь и сильные полярные группы, обеспечивающие растворимость в воде, находят большое практическое применение.
Величина g зависит уменьшением полярности молекул растворённого вещества. Так у органических кислот она выше, чем у солей этих кислот. Для молекул с большим числом полярных групп значения g невелики и в некоторых случаях близки к нулю. При исследовании гомологических рядов органических кислот были обнаружены чёткие изменения g в каждом ряду. Такие же результаты были получены для гомологических рядов спиртов, аминов и других. На основании полученных данных было сформулировано правило, заключающееся в том, что поверхностная активность увеличивается в 3 - 3,5 раза при удлинении углеводородной цепи на одно звено СН2. Пр имени ученых, выявивших эту закономерность оно было названным правилом Дюкло - Траубе. Правило Дюкло - Траубе лежит в основе синтеза ПАВ, обладающих высокой поверхностной активностью. Эти вещества, содержащие длинную углеводородную цепь и сильные полярные группы, обеспечивающие растворимость в воде, находят большое практическое применение.
Дата добавления: 2016-08-07; просмотров: 1475;
