Термодинамические параметры состояний
Термодинамические параметры состояний – физические величины. Характеризующие состояния термодинамической системы.
Параметры состояния:
1. внешние
2. внутренние
Внешними параметрами являются координаты термодинамической системы, скорость движения в пространстве.
Внутренние параметры организуют состояние термодинамической системы:
1.термодинамические
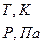
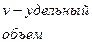
2. калорические 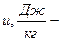 внутренняя энергия
внутренняя энергия
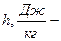 энтальпия
энтальпия
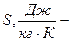 энтропия
энтропия
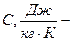 теплоемкость
теплоемкость
 энергия фазового перехода
энергия фазового перехода
(теплота парообразования)
Внутренние параметры состояния:
1.экстенсивние - зависят от размеров термодинамической
системы(m,v,внутренняя энергия)
2. интенсивные – не зависят от размеров термодинамической системы.
(плотность, удельные величины).
Основными параметрами состояния газа являются:
1.абсолютное давление P
2.абсолютная температура T
3.абсолютный объем V
1) P,Па
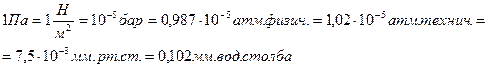
2) T,K
шкала Цельсия 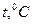
00- таяние льда
1000- кипение воды
шкала Кельвина 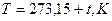
шкала Реомюра 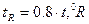
шкала Фаренгейта 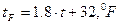
шкала Ренкина 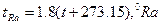
Температура - есть мера нагретости вещества, то есть мера интенсивности теплового движения микрочастиц.
Абсолютная температура пропорциональна кинетической энергии микрочастиц.
3) 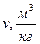 ;
; 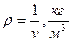
Нормативные условия – условия, при которых основные параметры состояния газа принимают следующие значения.

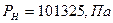
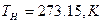
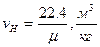
Основные параметры состояния газа, связаны между собой уравнениями состояния:
Уравнения состояния идеального газа, уравнение Клапейрона – Менделеева.
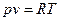 - для 1 кг газа;
- для 1 кг газа; 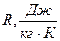
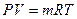 - для произвольного количества газа;
- для произвольного количества газа;
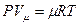 - для 1 кмоля;
- для 1 кмоля;
где 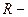 газовая характеристическая постоянная.
газовая характеристическая постоянная.
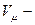 молярный объем;
молярный объем;
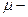 молярная масса;
молярная масса;
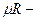 универсальная газовая постоянная;
универсальная газовая постоянная;
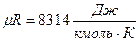
Уравнение Ван-дер-Ваальса: 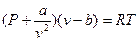
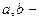 постоянная Ван-дер-Ваальса.
постоянная Ван-дер-Ваальса.
Газовые смеси
Газовая смесь – механическая смесь газов, химически между собой не взаимодействующих.
Пример: атмосферный воздух, горючий газ (азот), дымовые газы.
Масса газовой смеси равна сумме масс компонентов:
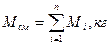
Парциальный объем, компонента газовой смеси – это объем, который имел бы данный компонент, если бы он один находился под давлением смеси и при температуре смеси.
|

| | |||||
| | |||||
| | |||||
Закон Омага согласно, которому объем газовой смеси равен сумме парциальных объемов компонентов:

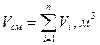
Парциальное давление компонентов газовой смеси – давление, которое имел бы данный компонент, если бы он один занимал весь объем смеси, находящийся при температуре смеси:

| | | |
Закон Дальтона: давление газовой смеси равна сумме парциальных давлений компонента.
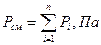
Кажущаяся молярная масса смеси – условное понятие, осредненная молярная масса всех компонентов смеси.
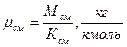
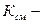 общее количество кмолей всех компонентов смеси.
общее количество кмолей всех компонентов смеси.
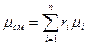
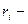 объемная доля компонента смеси;
объемная доля компонента смеси;
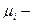 молярная масса компонента;
молярная масса компонента;
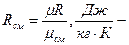 -газовая постоянная смеси
-газовая постоянная смеси
Теплоемкость
Теплоемкость физического тела равна количеству теплоты, которую нужно подвести к телу, чтобы нагреть его на 10.
Удельная теплоемкость – теплоемкость единицы количества вещества.
В зависимости от того, в чем выражается количество, различают удельные теплоемкости:
1.массовую
2.объемную
3.молярную
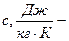 массовая
массовая
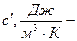 объемная
объемная
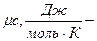 молярная
молярная
Величина теплоемкости зависит от условий нагрева.
Важное значение имеет изобарная теплоемкость, процесс идет при постоянном давлении 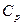
Изохорная теплоемкость, процесс идет при постоянном объеме 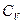
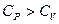
Уравнение Майера: 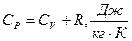
Физический смысл газовой постоянной: газовая постоянная равна работе, которую совершает 1 кг газа, при нагреве на 10 в изобарном процессе.
Различают истинную и среднюю теплоемкости:
Истинная теплоемкость определяется на бесконечно малом интервале температуры, представляет собой производную подведенной теплоты по температуре.
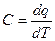
Средняя теплоемкость находится для конечного интервала температур равная отношению подведенной теплоты к разности температур в начале и конце процесса:
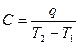
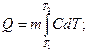
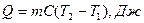
Теплоемкость сложной системы равна сумме теплоемкостей компонентов.
Дата добавления: 2016-07-09; просмотров: 801;
