Получение химических продуктов через метанол
Метанол (СН3ОН) - один из основных продуктов многотоннажной химии. Он используется для получения таких ценных химических продуктов как формальдегид, сложные эфиры, амины, растворители, уксусная кислота.
Впервые метанол был обнаружен еще в XVII веке Робертом Бойлем при изучении продуктов сухой перегонки древесины. Однако, очистить его от примесей (уксусной кислоты, ацетона) и получить по этой технологии чистый метиловый спирт удалось только через 200 лет. Сейчас процесс сухой перегонки древесины полностью вытеснен процессом получения метанола из синтез-газа. Впервые, этот каталитический синтез был применен в Германии в 1923 году фирмой BASF. В 1927 году в США был реализован промышленный синтез метанола, основанный не только на монооксиде но и на диоксиде углерода. В настоящее время существуют установки мощностью до 2000 т метанола в сутки, разработаны более активные катализаторы на основе цинка и меди, позволяющие снизить температуру процесса до 250°С, давление - до 5-10 МПа.
Мировой рынок метанола относительно невелик (32 млн. т), но спрос на него постоянно растет. Расширение спроса на этот спирт обусловлено, с одной стороны увеличением количества областей применения метанола, а с другой, - дефицитом природного сырья (нефть, газ).
Суммарное уравнение реакции получения метанола выглядит следующим образом:
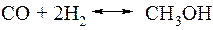
Реакция сильно экзотермична.
Основные направления переработки и использования метанола представлены на рис. 3.3.
Существует два пути переработки метанола:
1. Превращение метанола в низшие олефины.
2. Прямой синтез из метанола важных химических продуктов.
К плюсам первого можно отнести то, что последующая переработка олефинов идет по давно освоенным нефтехимическим процессам, которые, кстати, могут включать карбонилирование или гидроформилирование. Между тем, прямая конверсия метанола позволяет исключать значительные потери сырья, неизбежные при первом пути.
Наиболее важные направления использования метанола рассмотрены ниже.
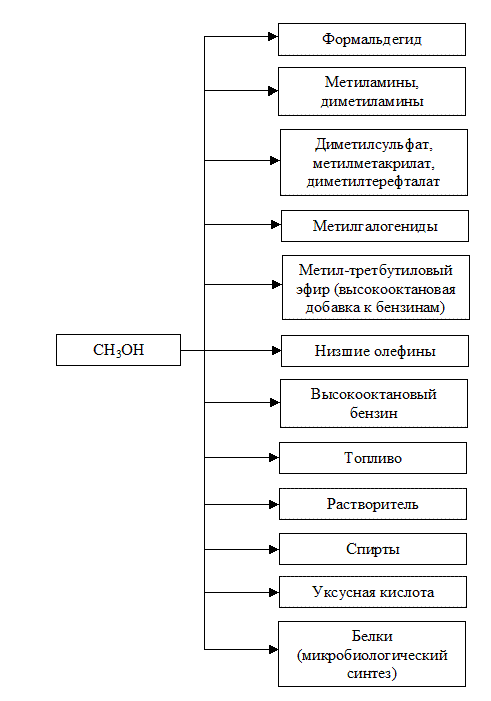
Рис. 3.3 Основные направления переработки метанола
Получение формальдегида
На получение формальдегида (НСНО) идет более 40 % производимого метанола. Формальдегид в основном используется для получения формальдегидных смол, широко используемых в промышленности полимеров (фенолформальдегидных, мочевиноформальдегидной и др.). В этих целях расходуется более 60 % производимого формальдегида. Кроме того, формальдегид используется как промежуточное вещество для получения изопрена, уротропина (гексаметилентетрамина) и других ценных веществ. Переработка метанола в формальдегид осуществляется двумя основными каталитическими способами:
а) Окисление метанола воздухом.

Процесс проводится с использованием серебряного катализатора при атмосферном давлении и температуре 650°С. Это хорошо освоенный процесс фирмы BASF и 80 % формальдегида получается именно по этому методу. Недавно был разработан новый технологический процесс с использованием железо-молибденовых катализаторов, что позволяет снизить температуру процесса до 300°С. В обоих случаях степень превращения составляет 99 %.
б) Дегидрирование метанола.
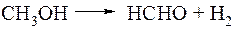
Этот процесс, осуществляемый на цинк-медных катализаторах при температуре 600°С пока не получил широкого распространения, но он является очень перспективным, так как получаемый формальдегид не содержит воды.
Уксусная кислота
Уксусная кислота (СН3СООН) - важнейший продукт органического синтеза, широко используемый в промышленности для получения сложных эфиров, мономеров (винилацетат), используемый в пищевой промышленности и т. д. Мировое производство уксусной кислоты достигает 5 млн. т/год. До недавнего времени практически всю уксусную кислоту получали по Уокер-процессу, использующему в качестве сырья этилен (нефть). Этилен в мягких условиях (130°С, атмосферное давление) окисляют кислородом воздуха до ацетальдегида в присутствие двух катализаторов PdCl2 и СиСl2, а затем ацетальдегид окисляется до уксусной кислоты:
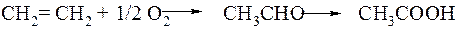
Также уксусную кислоту получали при окислении н-бутана при температуре 200°С и давлении 5 МПа в присутствие кобальтового катализатора. Известен и способ производства уксусной кислоты без катализатора.
В настоящее время эти процессы постепенно вытесняются новыми методами, основанными на использовании метанола.

Оба этих компонента могут быть получены как из природного газа, так и из угля, что делает процесс все более привлекательным по мере роста цен на нефтегазовое сырье. Существует два промышленных метода карбонилирования (присоединения СО) метанола. В более старом процессе фирмы BASF использовались кобальтовые катализаторы, процесс протекал при 250°С и 50-70 МПа. В другом процессе, представленном фирмой Monsanto в 1970 году, применяли родиевый катализатор и реакцию проводили при более мягких условиях (150-200°С, до 4 МПа). Именно процесс Monsanto называют новым направлением науки, которое носит название С1- химия.
Гомологизация метанола
Гомологизацией называется химическая реакция, в результате которой химическое соединение превращается в свой гомолог путем присоединения метиленовой группы. Впервые гомологизация метанола синтез-газом с образованием в качестве основного продукта этанола была осуществлена в 1940 году в Германии. Процесс проводили с участием оксида кобальта при 60 МПа.

Эта реакция вызвала огромный интерес, так как она позволяет получать этилен из синтез-газа:
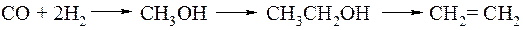
Применение в качестве катализатора карбонила кобальта Co2(CO)8 позволило понизить давление до 25 МПа, при этом степень превращения метанола составила 70 %, а этанол образовывался с селективностью 40 %. Побочные продукты реакции - ацетальдегид и эфиры уксусной кислоты. Впоследствии были предложены более селективные катализаторы на основе соединений кобальта и рутения с добавками фосфиновых лигандов (лиганды - основа комплексных соединений). Также было установлено, что реакция подвержена ускорению с помощью введения промоторов (доноров) - иодид-ионов. В настоящее время селективность по этанолу удалось поднять до 90%.
Дата добавления: 2016-06-24; просмотров: 1846;
