Окислители чрезвычайно токсичны для организма.
ТИПЫ ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
1) Межмолекулярные окислительно – восстановительные реакции, окислитель и восстановитель входят в состав молекул различных веществ.
+4 +7 +6 +2
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5 Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Na2SO3 - восстановитель, сера меняет степень окисления от +4 до +6
KMnO4 –окислитель, марганец меняет степень окисления с +7 до +2
2) внутримолекулярные окислительно – восстановительные реакции.
В этих реакциях и окислитель и восстановитель входят в состав одного и того же вещества.
_-3 +6 0 +3
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
Восстановитель азот, меняет степень окисления от -3 до 0,
окислитель хром, меняет степень окисления от +6 до +3.
3) реакции диспропорционирования, при которых один и тот же элемент, находящийся в промежуточной степени окисления является и окислителем и восстановителем.
0 -1 +1
2CI2 + 2Ca(OH)2 = CaCI2 + Ca(CIO)2 + 2H2O
CОСТАВЛЕНИЕ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Для составления уравнений окислительных – реакций используется метод электронного баланса. В основе его лежит следующее правило: общее число электронов, которое отдает восстановитель, должно быть равно общему числу электронов, которые присоединяет окислитель.
 Рассмотрим применение метода электронного баланса на примере реакции, которая выражается следующей схемой.
Рассмотрим применение метода электронного баланса на примере реакции, которая выражается следующей схемой.
KMnO4 + KBr + H2SO4 = MnSO4 + Br2 + K2SO4 + H2O
а) Определяем степени окисления всех элементов в молекулах исходных веществ и продуктов реакции:
+1 +7 -2 +1 -1 +1 +6 -2 +2 +6 -2 0 +1 +6 -2 +1 -2
KMnO4 + KBr + H2SO4 = MnSO4 + Br2 + K2SO4 + H2O
б) Находим элементы, которые изменяют степени окисления, это марганец и бром:
+7 -1 +2 0
KMnO4 + KBr + H2SO4 = MnSO4 + Br2 + K2SO4 + H2O
в) Составляем уравнения процессов окисления и восстановления:
Mn +7 + 5e = Mn+2 восстановление окислителя
2Br-1 - 2e = Br2 окисление восстановитель
г) Находим множители для уравнений процессов окисления и восстановления, при умножении на которые количество отданных и принятых электронов будут равны;
Mn +7 + 5e = Mn+2 |2 
2Br-1 - 2e = Br2 | 5
д) Найденные множители запишем как коэффициенты перед формулами веществ, которые содержат элементы, участвующие процессах окисления и восстановления:
2KMnO4 + 10KBr + H2SO4 = 2MnSO4 + 5Br2 + K2SO4 + H2O
е) Уравниваем число атомов элементов, которые не изменяют степени окисления. В данном случае это атомы калия, серы, водорода и кислорода:
2KMnO4 + 10KBr + 8H2SO4 = 2MnSO4 + 5Br2 + 6K2SO4 + 8H2O
Проверяем правильность уравнивания по равенству числа атомов кислорода в левой (40 атомов) и правой (40 атомов) частях уравнения.
ЭЛЕКТРОЛИЗ
Электролизом называется окислительно – восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Заряженные ионы электролита под действием электрического тока начинают двигаться к электродам: катионы к катоду (отрицательно заряженному электроду), анионы к аноду (положительно заряженному электроду).На катоде катионы принимают электроны и восстанавливаются, на аноде анионы отдают электроны и окисляются.
Электролиз расплавов и растворов протекает по разному т.к. в растворах дополнительно присутствуют ионы Н+ и ОН- , которые также участвуют в процессе электролиза.
Электролиз расплава. В теоретическом плане простейшим примером электролиза является электролиз расплава. Рассмотрим процесс электролиза расплава NaCI
NaCI = Na+ + CI–
Под действием электрического тока катионы движутся катоду и принимают от него электроны:
Катод (—) Na+ + e = Na0 – процесс восстановления.
Анионы CI– движутся к аноду и отдают электроны:
Катод (—) 2 CI– - 2е = CI2  - процесс окисления.
- процесс окисления.
Na+ + e = Na0
2 CI– — 2е = CI2 
Суммарное ионное уравнение электролиза : 2Na+ + 2 CI– = 2Na0 + CI2 
Суммарное молекулярное уравнение: 2NaCI = 2Na + CI2 
На катоде выделяется металлический натрий, на аноде – газообразный хлор. Это реакция окислительно - восстановительная, на катоде всегда идет процесс восстановления, на аноде всегда идет процесс окисления.
Электролиз растворов.Процесс на катоде.
1.Если катион электролита находится в начале электрохимического ряда (по AI включительно), то на катоде идет процесс восстановления воды (выделяется Н2). Катионы металла не восстанавливаются, остаются в растворе.
2.Если катион электролита находится в ряду между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла и молекулы воды.
3.Если катион электролита находится в ряду напряжения после водорода, то на катоде идет только процесс восстановления ионов металла.
4.Если в растворе находится смесь катионов разных металлов, то первыми восстанавливаются катионы менее активных металлов.
Катодные процессы в водных растворах солей
| Li, K, Ca, Na, Mg, Al | Mn, Zn, Fe, Ni, Sn, Pb | H2 | Cu, Hg, Ag, Pt, Au |
| Men+ - металл не востанавливается | Men+ + Me0 | Men+ +2e = Me0 | |
2Н2О + 2е = Н2  + 2ОН— + 2ОН—
| 2Н2О + 2е = Н2  + 2ОН— + 2ОН—
|
Процесс на аноде. Продукты электролиза зависят от материала анода и природы аниона.
1. Если анод растворимый (железо, медь, серебро), то независимо от природы аниона всегда идет окисление металла анода.
2. Если анод нерастворимый (уголь, графит, платина, золото), то анионы безкислородных кислот (за исключением фторидов) окисляются на аноде, а анионы оксокислот и фториды не окисляются на аноде, а идет окисление воды с выделением кислорода. При электролизе щелочей идет окисление гидроксид ионов.
Анодные процессы в водных растворах
| Анод | Анионы безкислородные | Анионы кислородсодержащие |
Нерастворимы  й й
| Окисление аниона (кроме фторидов) Асm — +me = Ас0 | В щелочной среде
4ОН—— 4е = О2  + 2Н2О
В кислой, нейтральной средах
2Н2О — 4е = О2 + 2Н2О
В кислой, нейтральной средах
2Н2О — 4е = О2  + 4Н+ + 4Н+
|
| Растворимый | Окисление металла анода Ме0 —ne = Меn+ Анод раствор | Окисление металла анода Ме0 —ne = Меn+ Анод раствор |
Массу вещества, образовавшегося при электролизе найти исходя из закона Фарадея:
 , где m - масса вещества, М – молярная масса, n - количество отданных или принятых электронов, F – число Фарадея (96500 Кл/моль) = А·ч/моль), I – сила тока (А), t - продолжительность процесса.
, где m - масса вещества, М – молярная масса, n - количество отданных или принятых электронов, F – число Фарадея (96500 Кл/моль) = А·ч/моль), I – сила тока (А), t - продолжительность процесса.
Электролиз используется для выделения и очистки металлов, получения щелочей, хлора, водорода. Алюминий, магний, натрий, кадмий получают только электролизом. Очистку меди, никеля, свинца проводят целиком электрохимическим методом. Для защиты от коррозии электрохимическим методом на поверхность металлических изделий наносится тонкий слой другого металла (хрома, серебра, меди, никеля, золота), устойчивого к коррозии.
ХИМИЧЕСКИЕ ИСТОЧНИКИ ЭЛЕКТРИЧЕСКОЙ ЭНЕРГИИ
Устройства, которые применяют для непосредственного преобразования энергии химических реакций в электрическую энергию, называют гальваническими элементами или химическими источниками электрической энергии. Действие любого гальванического элемента основано на протекании в нем окислительно – восстановительной реакции. 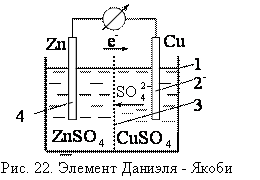
При замкнутой цепи цинк окисляется, ионы цинка переходят в раствор, электроны движутся по внешней цепи к медному электроду.
На медном электроде происходит восстановление ионов меди из раствора, медь выделяется на пластинке. Цинковый электрод является анодом, медный катодом, цинк растворяется, медь выделяется из раствора, сульфат анионы движутся через пористую перегородку от медного к цинковому электроду.
Процесс на аноде Zn = Zn+2 + 2e
Процесс на катоде Cu+2 + 2e = Cu
Суммарное уравнение: Zn + Cu+2 = Zn+2 + Cu
Молекулярное уравнение: Zn + CuSO4 = Zn SO4 + Cu
Кратко строение элемента Даниэля – Якоби можно записать следующей схемой:
Zn|ZnSO4(р) || CuSO4(р)|Cu
Таким образом, при работе гальванического элемента электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов. В настоящее время используются различные гальванические элементы: железо – никелевые, кадмиево – никелевые, серебряно – цинковые, свинцовые, и др. их называют аккумуляторами. В свинцовом аккумуляторе одни пластины заполнены дооксидом свинца, другие губчатым свинцом. Металлический свинец при работе аккумулятора является анодом и окисляется:
Pb + SO4-2 = PbSO4 +2e
Диоксид свинца является катодом, он восстанавливается:
PbO2 + SO4-2 + 4H+ + 2e = PbSO4 +2H2O
Суммарный процесс: Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
При зарядке, через аккумулятор пропускают электрический ток и в результате этого электрохимические процессы на электродах протекают в обратном направлении.
Свинцовый электрод становится катодом, на нем протекает процесс восстановления:
PbSO4 +2e = Pb + SO4-2
На электроде из PbO2 происходит процесс окисления:
PbSO4 + 2H2O = PbO2 + SO4-2 + 4H+ + 2e
 ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
Электродвижущая сила гальванического элемента равна алгебраической сумме электродных потенциалов электродов.
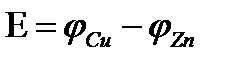


Скачок потенциала, возникающий на границе раздела металл – раствор его соли, называется электродным или окислительно – восстановительным потенциало ( 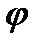 ). Зависимость электродного потенциала от природы металла, концентрации его ионов в растворе и температуры количественно выражается уравнением В. Нернста.
). Зависимость электродного потенциала от природы металла, концентрации его ионов в растворе и температуры количественно выражается уравнением В. Нернста. 
 , где F - число Фарадея
, где F - число Фарадея
равно 96500Кл/моль, z – заряд иона, R – газовая постоянная 8,31Дж/моль·К, Т температура по Кельвину,  - стандартный электродный потенциал металла. Подставляя в формулу число Фарадея, температуру 298К, газовую постоянную и десятичный логарифм, получаем:
- стандартный электродный потенциал металла. Подставляя в формулу число Фарадея, температуру 298К, газовую постоянную и десятичный логарифм, получаем:

Стандартным электродным потенциалом металла  называется скачок потенциала на границе раздела металл - раствор его соли с концентрацией 1 моль/л.
называется скачок потенциала на границе раздела металл - раствор его соли с концентрацией 1 моль/л.
Для измерения электродных потенциалов собирают гальваническую цепь, состоящую из исследуемого электрода и стандартного водородного электрода. Водородный электрод представляет собой платиновую пластинку, насыщенную газообразным водородом, которая опущена в водный раствор кислоты. Потенциал стандартного водородного электрода принят равным нулю. Например: для цинкового электрода:
Zn|ZnSO4|| H2SO4 |H2,Pt
Потенциал цинкового электрода будет равен ЭДС такого гальванического элемента с обратным знаком, если берется медный электрод, то его потенциал будет равен ЭДС гальванического элемента.
Последовательность металлов, расположенных в порядке убывания (возрастания) значений их электродных потенциалов, называется рядом напряжения или рядом активности металлов. В гальванических элементах более активный металл является анодом (он растворяется при работе гальванического элемента), а менее активный катодом. Для расчета ЭДС гальванического элемента из потенциала менее активного металла отнимается потенциал более активного металла.
Например: стандартный потенциал цинкового электрода равен -0,76 В, медного 0,35В. ЭДС = 0,35 – (-0,76) = 1,11В.
Дата добавления: 2016-06-24; просмотров: 1066;
