Классификация ферментов
Номенклатура ферментов складывалась постепенно, по мере их открытия и изучения. Названия ферментов вначале носили случайный характер. Например, фермент, расщепляющий крахмал, был назван диастазом, а фермент желудочного сока, расщепляющий белки, – пепсином. Позднее название фермента стали составлять из корня слова, обозначающего вещество, на которое действует фермент, добавляя к нему окончание «аза». Фермент, расщепляющий крахмал (амилум), стали называть амилазой, фермент, разлагающий мальтозу, – мальтазой и т. п. Наряду с этим ферменты называют и по функции – по химическим процессам, которые они катализируют. Например, ферменты, катализирующие отщепление водорода от субстрата (дегидрогенерирование), называют дегидрогеназами, а расщепляющие сложные органические соединения путем гидролиза – гидролазами и т. д.
В соответствии с принятой в настоящее время классификацией ферментов (Правила номенклатуры ферментов, 1972) все ферменты делят на 6 классов: 1–оксидоредуктазы; 2 – транс-феразы; 3 – гидролазы; 4 – лиазы; 5 – изомеразы; 6 – лигазы. Классы подразделяют на подклассы, которые делят на под-подклассы. Каждый фермент имеет название и шифр из четырех цифр. Первая цифра обозначает класс, вторая – подкласс, третья – подподкласс, четвертая – порядковый номер данного фермента.
В настоящее время известно более 1000 ферментов.
Ниже рассматриваются только некоторые наиболее распространенные ферменты микроорганизмов.
Оксидоредуктазы– окислительно-восстановительные ферменты.В этот класс входят многочисленные ферменты, катализирующие окислительно-восстановительные реакции процессов дыхания и брожения микроорганизмов. Среди оксидоредуктаз различают следующие ферменты.
Дегидрогеназы – ферменты, катализирующие реакцию де-гидрогенерирования органических соединений: отщепление водорода. Отнятый водород передается дегидрогеназой какому-либо другому веществу (промежуточному – временному или конечному акцептору водорода). Одновременно одно вещество окисляется, а другое восстанавливается.
Дегидрогеназы специфичны по отношению к донору водорода (веществу, подвергающемуся дегидрогенерированию) и к акцептору водорода. Их делят на анаэробные и аэробные.
Анаэробные (первичные) дегидрогеназы передают отнятый от окисляемого субстрата водород другим дегид-рогеназам или молекулам каких-либо органических веществ. Эти дегидрогеназы являются двухкомпонентными ферментами. Их простетическая группа при диализе легко отделяется в виде кофермента.
Коферменты анаэробных дегидрогеназ построены по типу динуклеотидов. Каждый нуклеотид содержит органическое основание (чаще гетероциклическое), которое через пентозу соединено с фосфорной кислотой. Коферментом многих анаэробных дегидрогеназ является никотинамидадениндинуклеотид (сокращенно НАД).
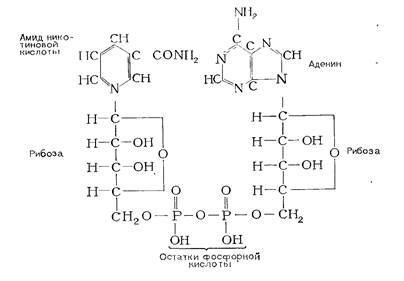
Кофермент, присоединяя водород от окисляемого вещества, превращается в восстановленную форму – НАД·Н2. Передавая затем водород другому веществу, он восстанавливает его, а НАД · Нг снова превращается в НАД (окисляется).
Анаэробные дегидрогеназы имеются как у анаэробов, так и у аэробов (см. с. 65).
Аэробные (вторичные) дегидрогеназы передают активированный водород, отнятый у окисляемого вещества или от восстановленной анаэробной^ дегидрогеназы, кислороду воздуха непосредственно либо через промежуточных переносчиков.
Аэробные дегидрогеназы, передающие водород субстрата только непосредственно кислороду, называют оксидазами. К оксидазам относится, например, полифенолоксидаза, катализирующая реакцию окисления полифенолов с образованием темноокрашенных соединений меланинов. Этот фермент имеется у многих плесневых грибов. Действие полифенолоксидазы проявляется в потемнении тканей плодов и овощей, пораженных этими плесенями.
К аэробным дегидрогеназам относятся флавиновые ферменты, коферментом которых является флавин-аденин-дину-клеотид (ФАД). Поскольку в состав кофермента входит рибофлавин (витамин В2), флавиновые ферменты окрашены в желтый цвет. Одни флавиновые ферменты могут переносить водород непосредственно на кислород, т. е. являются оксидазами; другие передают водород от окисляющихся веществ кислороду через ряд промежуточных переносчиков. В таких случаях участвуют системы ферментов, а водород многократно переносится от одного вещества к другому, пока не достигнет своего конечного акцептора – кислорода. Последний подвергается восстановлению с образованием воды или перекиси водорода.
Особо важное значение в процессах аэробного дыхания имеет цитохромная ферментная система, состоящая из цитохро-мов и фермента цитохромоксидазы.
Цитохромы представляют собой гемопротеиды. В состав простетической группы (гема) входит двухвалентное железо. Роль цитохромов в процессе дыхания заключается в последовательном переносе электронов от водородного атома восстановленной дегидрогеназы на цитохромоксидазу.
Цитохромоксидаза – двухкомпонентный гемосодержа-щий фермент, катализирует окислительно-восстановительную реакцию между восстановленным цитохромом (последним в цепи цитохромов) и кислородом (см. с. 69).
Цитохромная система содержится в клетках всех микроорганизмов, за исключением облигатно-анаэробных бактерий.
Пероксидаза – железосодержащий двухкомпонентный фермент, катализирующий окисление органических веществ с помощью перекиси водорода или каких-либо органических перекисей. Перекиси действуют как акцепторы водорода.
Каталаза – двухкомпонентный фермент, простетическая группа которого аналогична таковой у пероксидазы. Каталаза расщепляет перекись водорода на воду и молекулярный кислород. В процессе дыхания нередко образуется перекись водорода – вещество, ядовитое для клетки.
Трансферазы – ферменты переноса.Ферменты этой группы катализируют перенос атомных группировок от одного соединения к другому. Известно много таких ферментов; их различают по тем группам, перенос которых они катализируют.
Наиболее важное значение в обмене веществ имеют фосфо-трансферазы и аминотрансферазы.
Фосфотрансферазы (киназы) катализируют перенос остатков фосфорной кислоты с одного вещества на другое вещество.
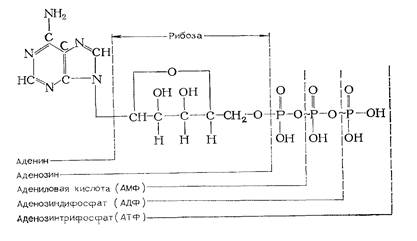
Большинство реакций переноса фосфатных групп протекает с участием аденозинтрифосфата (АТФ) и аденозиндифос-фата (АДФ). Эти реакции имеют большое значение, благодаря им осуществляется перенос энергии с одного вещества на другое.
Из приведенной ниже формулы АТФ видно, что это соединение имет одну простую связь (–) и две макроэргических (богатых энергией), обозначаемых значком (~). При гидролизе обычной фосфатной связи освобождается 8,4·103–12,6·103 Дж на грамм-молекулу отщепленного фосфата, а при гидролизе макроэргической связи – около 4,2 • 104 Дж.
Примером фосфотрансфераз может служить гексоки-н а з а – фермент, катализирующий перенос остатка фосфорной кислоты с АТФ на глюкозу. При этом образуются фосфорный эфир глюкозы и АДФ:
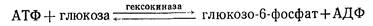
Фосфатная группа с АТФ может быть перенесена и на другие органические вещества.
Фосфотрансферазы участвуют в процессах дыхания и брожения.
Аминотрансферазы – ферменты, осуществляющие реакции переаминирования, т. е. межмолекулярный перенос аминогруппы (–NH2) с аминокислот на кетокислоты. Эти ферменты обладают специфичностью: каждый катализирует реакцию переноса аминогруппы от определенной аминокислоты. Они являются двухкомпонентными ферментами, в состав кофермента входит витамин Вб. В обмене веществ аминоферазы играют большую роль, участвуют в образовании новых аминокислот в клетке.
Гидролазы.К гидролазам относятся ферменты,катализирующие процессы расщепления сложных органических веществ по типу гидролитических реакций с присоединением воды.
Большинство гидролаз являются однокомпонентными ферментами.
Гидролазы подразделяют на подгруппы в зависимости от веществ, на которые они действуют.
Карбогидразы – это ферменты, катализирующие гидролиз и синтез глюкозидов, ди-, три- и полисахаридов.
Примерами карбогидраз, расщепляющих дисахариды, распространенных у Микроорганизмов, являются следующие ферменты.
Мальтаза (α-глюкозидаза) расщепляет мальтозу (солодовый сахар) на две молекулы глюкозы.
Сахараз а (инвертаза, β-фруктофуранозидаза) расщепляет сахарозу на глюкозу и фруктозу.
Лакта за (β-галактозидаза) расщепляет молочный сахар (лактозу) на галактозу и глюкозу.
Из гидролаз, действующих на полисахариды, наибольшее значение имеют следующие.
Амилазы – ферменты, катализирующие гидролиз крахмала. Известно три типа амилаз: а-амилаза, β-амилаза и глюкоамилаза. Они отличаются между собой по свойствам и способу действия на крахмал. Амилазы находятся в плесневых грибах и многих бактериях. Дрожжи не содержат амилаз.
α-Амилаза расщепляет крахмал преимущественно на сравнительно низкомолекулярные декстрины. Мальтозы получается мало.
β-Амилаза расщепляет крахмал с образованием главным образом мальтозы и небольшого количества декстринов (высокомолекулярных) .
Глюкоамилаза расщепляет крахмал, образуя преимущественно глюкозу и небольшое количество декстринов.
Целлюлаза – фермент, гидролизующий целлюлозу (клетчатку) с образованием дисахарида целлобиозы, который в дальнейшем при участии фермента целлобиазы (β-глюкозидазы) расщепляется на две молекулы глюкозы. Целлюлаза встречается в грибах и некоторых бактериях.
Пектолитические ферменты – это комплекс ферментов, гидролизующих пектиновые вещества. Пектиновые вещества в виде нерастворимого протопектина находятся в растениях в качестве межклеточного вещества и входят в состав клеточных оболочек. При участии пектолитических ферментов (протопектиназы, пектинэстеразы, полигалактуроназы) протопектин и растворимый пектин гидролизуются с образованием метилового спирта, галактуроновых кислот, пентоз, гексоз.
Пектолитические ферменты имеются у многих плесеней и у некоторых бактерий. Развитие этих микроорганизмов в растительном пищевом сырье (плодах, овощах) приводит к мацерации (размягчению) их тканей.
Пептидазы (протеолитические ферменты) катализируют гидролиз белков, пептидов, расщепляя пептидные связи. Пептидазы обладают специфичностью, которая обусловлена структурой молекулы белка, наличием и расположением определенных химических групп. Каждая пептидаза разрывает пептидные связи между определенными аминокислотами.
Дезаминазы и амидазы – ферменты, катализирующие гидролитическое расщепление аминокислот и амидов с отщеплением азота в виде аммиака.
Из амидаз существенную роль в азотном обмене микроорганизмов играют аспарагиназа, катализирующая гидролиз ас-парагина на аспарагиновую кислоту и аммиак, а также глу-таминаза, вызывающая гидролиз глутамина с образованием аммиака и глутаминовой кислоты.
Эстеразы – ферменты, катализирующие реакции расщепления и синтеза сложных эфиров(эстеров). Они широко распространены у микроорганизмов. Важную роль в обмене веществ микроорганизмов играют следующие эстеразы.
Липазы – ферменты, вызывающие гидролиз жиров на глицерин и высокомолекулярные жирные кислоты.
Фосфатазы – многочисленные ферменты, расщепляющие эфироподобные фосфорсодержащие органические соединения с освобождением фосфорной кислоты.
Лиазы. К классу лиаз относятся ферменты, которые катализируют реакции негидролитического расщепления органических веществ, сопровождаемые отщеплением от субстрата тех или иных групп: СО2, Н2О, NH3.
Альдолаза – фермент, обратимо расщепляющий шести-углеродную молекулу фруктозодифосфата на два трехуглерод-ных соединения: фосфодиоксиацетон и фосфоглицериновый альдегид. Этот фермент участвует в начальной стадии превращения сахара в процессе дыхания и брожения.
Декарбоксилазы – ферменты, катализирующие декарбоксилирование (отщепление СО2) органических кислот.
Во многих микроорганизмах содержится, например, пируватдекарбоксилаза, катализирующая отщепление СО2 от пировиноградной кислоты с образованием уксусного альдегида. В состав кофермента этой декарбоксилазы входит витамин B1.
Декарбоксилазы аминокислот участвуют в отщеплении СО2 от аминокислот с выделением аминов.
Микроорганизмы, особенно гнилостные бактерии, богаты декарбоксилазами аминокислот.
Изомеразы. Ферменты этого класса катализируют превращение органических соединений в их изомеры – внутримолекулярное перемещение радикалов, атомов, атомных группировок.
Примерами могут служить следующие ферменты.
Триозофосфатизомераза катализирует взаимное превращение фосфотриоз: фосфодиоксиацетона и фосфоглицеринового альдегида.
Глюкозофосфатизомераза катализирует обратимое превращение глюкозо-6-фосфат во фруктозо-6-фосфат.
Оба этих фермента участвуют на первых стадиях превращения сахара в процессах дыхания и брожения.
Лигазы (синтетазы). В этот класс входят ферменты, катализирующие реакции синтеза сложных органических соединений из более простых. Эти реакции требуют затрат энергии и обычно протекают одновременно с расщеплением пирофосфатной (мак-роэргической) связи в АТФ.
Примерами таких ферментов являются следующие.
Карбоксилазы катализируют при участии AT Φ присоединение СОг к'органическим кислотам.
Глутаминсинтетаза и аспарагинсинтетаза – ферменты синтеза глутамина и аспарагина из NH3 и соответствующих аминокислот.
Лигазы играют большую роль в углеводном и азотном обмене микроорганизмов.
Дата добавления: 2016-06-13; просмотров: 1987;
